
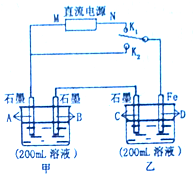
 如图所示,甲、乙两个烧杯中的溶液中溶质离子分别由Na+、Cu2+、Cl-、SO42-四种离子中的一种阳离子和一种阴离子组成.(每种离子只能选用一次)
如图所示,甲、乙两个烧杯中的溶液中溶质离子分别由Na+、Cu2+、Cl-、SO42-四种离子中的一种阳离子和一种阴离子组成.(每种离子只能选用一次)分析 Ⅰ、闭合K1断开K2,为电解池,甲池中在A、B两极上产生等体积的气体,说明甲为NaCl溶液,乙为CuSO4溶液,D极的质量增加说明D为阴极,M为正极,N为负极,
(1)甲为NaCl溶液,B为阴极,氢离子在阴极放电生成氢气;
(2)乙为CuSO4溶液,电解硫酸铜溶液时生成硫酸、氧气和铜,N为负极;
Ⅱ、闭合K2、断开K1,Fe为活泼金属,能够与铜离子反应,所以乙池为原电池,Fe电极为负极,Fe失电子生成亚铁离子,C电极上铜离子得电子生成Cu,生成0.64gCu转移0.02mol电子,据电子守恒计算甲池中电解NaCl溶液的pH变化.
解答 解:I、(1)闭合K1断开K2,为电解池,甲池中在A、B两极上产生等体积的气体,说明甲为NaCl溶液,乙为CuSO4溶液,D极的质量增加说明D为阴极,M为正极,N为负极,B为阴极,氢离子在阴极放电生成氢气,电极反应式为:2H++2e-=H2↑,故答案为:NaCl;2H++2e-=H2↑;
(2)乙为CuSO4溶液,电解硫酸铜溶液时生成硫酸、氧气和铜,电解方程是为2CuSO4+2H2O电解?2Cu+2H2SO4+O2↑,D极的质量增加说明D为阴极,M为正极,N为负极,故答案为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+2H2SO4+O2↑;负极;
Ⅱ、闭合K2、断开K1,Fe为活泼金属,能够与铜离子反应,所以乙池为原电池,Fe电极为负极,Fe失电子生成亚铁离子,电极反应式为Fe-2e-=Fe2+,C电极上铜离子得电子生成Cu,生成0.64gCu转移0.02mol电子,据电子守恒,甲池中电解NaCl溶液生成的NaOH为0.02mol,c(OH-)=0.1mol/L,pH=13,
故答案为:原电池;Fe-2e-=Fe2+;0.02NA或1.204×1022;13.
点评 本题考查了原电池和电解池相关知识以及多池相连时原电池、电解池的判断,分析电极材料是解答的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na2O Na${\;}_{2}^{+}$[${\;}_{×}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{×}^{•}$]2- | |
| B. | H2S H+[${\;}_{×}^{•}$$\underset{\stackrel{••}{S}}{••}$${\;}_{×}^{•}$]2-H+ | |
| C. | H2O2 H${\;}_{×}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{×}^{•}$H | |
| D. | N2 N${\;}_{•}^{•}$${\;}_{•}^{•}$${\;}_{•}^{•}$N |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
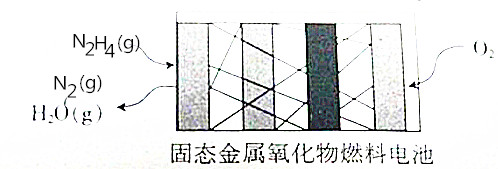 N2H4是一种新能源,直接供肼式固态金属氧化物(提供可移动的O2-微粒)燃料电池的结构如图所示,下列有关说法正确的是( )
N2H4是一种新能源,直接供肼式固态金属氧化物(提供可移动的O2-微粒)燃料电池的结构如图所示,下列有关说法正确的是( )| A. | 通人N2H4的一极发生还原反应,该极为正极 | |
| B. | 正极的电极反应式为O2+2H2O+4e-=4OH- | |
| C. | 该电池将化学能全部转化为电能 | |
| D. | 电池反应式为N2H4+O2=N2+2H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有8个副族 | B. | 元素周期表有18个纵行 | ||
| C. | 短周期是指第一、二周期 | D. | IA族的元素全部是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
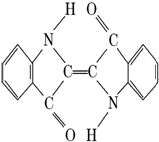 历史上最早应用的还原性染料是靛蓝,其结构简式如右图,下列关于靛蓝的叙述中错误的是( )
历史上最早应用的还原性染料是靛蓝,其结构简式如右图,下列关于靛蓝的叙述中错误的是( )| A. | 靛蓝由碳、氢、氧、氮四种元素组成 | B. | 它的分子式是C16H10N2O2 | ||
| C. | 该物质属于芳香化合物 | D. | 它含有碳碳双键和酯基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是一种共价化合物 | |
| B. | 在加热时此化合物可以分解为PH3和HI | |
| C. | 这种化合物不能跟碱反应 | |
| D. | 该化合物中每个原子的最外层都满足8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)?5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )
利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)?5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )| A. | b点时,CO的转化率为20% | |
| B. | 容器内的压强保持恒定,表明反应达到平衡状态 | |
| C. | b点和d点的化学平衡常数:Kb>Kd | |
| D. | 0到0.5min反应速率V(CO)=0.3mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com