
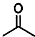
 ,则键线式为
,则键线式为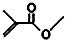 的物质的分子式为C5H8O2.
的物质的分子式为C5H8O2. 科目:高中化学 来源: 题型:选择题
| A. | Zn+2HCl═ZnCl2+H2↑ | B. | O2+4HCl═2Cl2+2H2O | ||
| C. | MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O | D. | 2HCl═Cl2+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
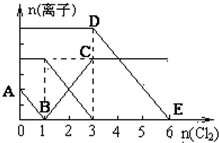 已知:2Fe3++2I-═2Fe2++I2,向1L含有Fe2+、I━、Br━的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )
已知:2Fe3++2I-═2Fe2++I2,向1L含有Fe2+、I━、Br━的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )| A. | 线段BC代表Fe3+物质的量的变化情况 | |
| B. | 原混合溶液中c(FeBr2)=6 mol/L | |
| C. | 原溶液中n (Fe2+):n (I-):n(Br-)=2:1:3 | |
| D. | 当通入Cl22mol时,溶液中已发生的反应可表示为2Fe2++2I━+2Cl2═2Fe3++I2+4Cl━ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 现象 | 单质B的相关性质(填序号) | 相关的化学方程式 | |
| Ⅰ | 单质B浮在水面上 | ||
| Ⅱ | 熔成一个小球 | ||
| Ⅲ | 四处游动,发出嘶嘶的声音 | ||
| Ⅳ | 滴入酚酞试剂,溶液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物中铁单质物质的量的范围:0.03 mol<n(Fe)<0.07 mol | |
| B. | 往得到的溶液中加入NaOH溶液现象为白色沉淀转化为灰绿色最后变为红褐色 | |
| C. | n(Fe)<n(Fe2O3) | |
| D. | 反应后所得溶液中的Fe2+与Cl-的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
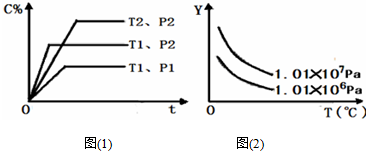
| A. | 反应物A的百分含量 | B. | 反应物B的平衡转化率 | ||
| C. | 平衡混合气的密度 | D. | 平衡混合气的总物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH+HCl与KOH+CH3COOH | B. | NaOH+H2SO4与 Ba(OH)2+H2SO4 | ||
| C. | BaCl2+H2SO4与Ba(OH)2+Na2SO4 | D. | CaCO3+H2SO4 与Na2CO3+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:实验题
用中和滴定法测定烧碱的纯度,试根据实验回答:
(1)准确称取4.1g烧碱样品,所用主要仪器是 。
(2)将样品配成250mL待测液,需要的仪器有 。
(3)取10.00mL待测液,用 量取。
(4)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时 手旋转酸式滴定管的玻璃活塞, 手不停地摇动锥形瓶,两眼注视 ,直到滴定终点。
(5)根据下列数据,计算待测烧碱溶液的浓度为: ,样品烧碱的质量分数为________________。(假设烧碱中不含有与酸反应的杂质)
滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(6)滴定过程(酚酞作指示剂),下列情况会使测定结果偏高的是 。
①酸式滴定管用水洗后便装液体进行滴定;②碱式滴定管水洗后,就用来量取待测液;③锥形瓶用蒸馏水洗涤后,又用待测液润洗;④滴定过快成细流、将碱液溅到锥形瓶壁而又未摇匀洗下;⑤盐酸在滴定时溅出锥形瓶外;⑥滴加盐酸,溶液颜色褪去但不足半分钟又恢复红色;⑦滴定前,酸式滴定管有气泡,滴定后消失;⑧记录起始体 积时,仰视读数,终点时俯视。
积时,仰视读数,终点时俯视。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com