


科目:高中化学 来源: 题型:
| A、2.4g金属镁变为镁离子时失去的电子数为0.1NA |
| B、1molHCl气体中的粒子数与0.5 mol/L盐酸中溶质粒子数相等 |
| C、任何条件下,16gCH4与18gH2O所含有电子数均为10NA |
| D、22.4L的CO气体与1molN2所含的电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用盐酸除金属表面的锈是物理变化,食盐水导电是化学变化 |
| B、热的饱和KNO3溶液降温析出晶体是物理变化,二硫化碳洗涤试管内壁上的硫是化学变化 |
| C、混合物:铝热剂 液氯 水玻璃 明矾 |
| D、化合物:干冰 冰水混合物 烧碱 小苏打 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽车排气管中CO和NOX反应的化学方程式为:2XCO+2NOX=2XCO2+N2 |
| B、植树造林,增大绿化面积,可有效控制城市空气的污染 |
| C、汽车改用天然气或氢气为燃料,都会减少对空气的污染 |
| D、此治理方法缺点是大大提高了空气的酸度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ksp(AgI)小于Ksp(AgCl)g,AgI不能转化为AgCl | ||||
| B、两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的难溶物 | ||||
| C、AgI比AgCl更难溶于水,所以AgCl可以转化为AgI | ||||
D、常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于
|
查看答案和解析>>
科目:高中化学 来源: 题型:
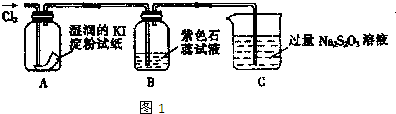
| ||
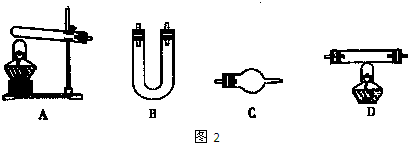
| 选用的仪器(填字母) | 加入的试剂 | 作用 |
| 反应器(或产生气体) | ||
| 氧化铜 | 使氨气与氧化铜反应 | |
| C |
查看答案和解析>>
科目:高中化学 来源: 题型:
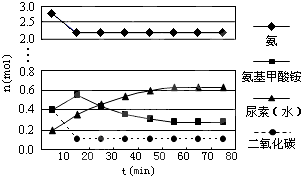
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、 |
C、 |
D、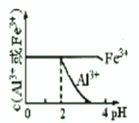 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com