
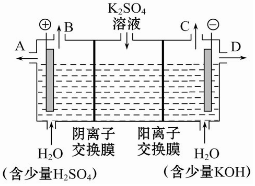
 如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾.
如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾.科目:高中化学 来源: 题型:选择题
| A. | 形成离子键的阴阳离子键只存在静电吸引力 | |
| B. | HF、HCl、HBr、HI的还原性从左到右依次减弱 | |
| C. | ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| D. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 工业上常用电解法制备元素C、D、E的单质 | |
| C. | 常温下,元素B、D的最高价氧化物对应的水化物之间能发生反应 | |
| D. | 化合物AE与CE具有相同类型的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a≥2b时,发生的离子反应为:2OH-+CO2═CO32-+H2O | |
| B. | 当a=1.25b时,发生的离子方程式为:5OH-+4CO2═3HCO3-+CO32-+H2O | |
| C. | $\frac{2b}{3}$<a<2b时,溶液中CO32-与HCO3-物质的量之比为:(2b-a):(2a-b) | |
| D. | 若反应后溶液中CO32-与OH-物质的量之比为2:1,则5b=a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
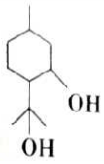 孟二醇的结构简式如图所示,W是孟二醇的同分异构体,W可水解生成碳原子数相同的两种有机物.下列有关说法正确的是( )
孟二醇的结构简式如图所示,W是孟二醇的同分异构体,W可水解生成碳原子数相同的两种有机物.下列有关说法正确的是( )| A. | 孟二醇与乙醇属于同系物 | |
| B. | 常温常压下,1mol孟二醇与足量的钠反应可生成22.4LH2 | |
| C. | W的两种水解产物均可与NaHCO3溶液反应放出CO2 | |
| D. | W的结构有32种(不含立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4分子的比例模型: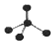 | B. | 乙酸的化学式:C2H4O2 | ||
| C. | 乙烯的结构简式CH2CH2 | D. | F-的结构示意图: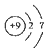 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com