
 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题:
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题:| 1 |
| 5 |
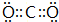 ;D的化学式为NaHCO3,
;D的化学式为NaHCO3,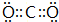 ;NaHCO3;
;NaHCO3;| 1 |
| 5 |
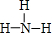 ,D为硝酸,属于共价化合物,故答案为:
,D为硝酸,属于共价化合物,故答案为: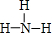 ;共价;
;共价;
| ||
| △ |
| ||
| △ |


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
| A、若HA的电离能力大于A-的水解能力,则有c(A-)>c(HA)>c(Na-)>c(OH-)>c(H-) |
| B、若该溶液中A-水解能力大于HA电离能力,则有c(A-)>c(HA)>c(Na-)>c(OH-)>c(OH+) |
| C、无论该溶液呈酸性还是碱性,都有c(Na+)=c(A-)+c(OH-) |
| D、无论该溶液呈酸性还是碱性,都有c(Na+)+c(H+)=c(A-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、烧杯a中的溶液pH升高 |
| B、烧杯b中发生氧化反应 |
| C、盐桥中的阳离子移向烧杯a |
| D、电子从烧杯a经盐桥移向烧杯b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5x L | B、11x L |
| C、12x L | D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子中三个碳原子可能处在同一直线上 |
| B、它的五氯代物种数比三氯代物多 |
| C、它属于烃类 |
| D、它的分子中既有极性键又有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 25℃时,向20.00ml的NaOH溶液中逐滴加入某浓度的CH3COOH溶液.滴定过程中,溶液的pH与滴入CH3COOH溶液的体积的关系如图所示,②点时NaOH溶液恰好被中和.则下列说法中,错误的是( )
25℃时,向20.00ml的NaOH溶液中逐滴加入某浓度的CH3COOH溶液.滴定过程中,溶液的pH与滴入CH3COOH溶液的体积的关系如图所示,②点时NaOH溶液恰好被中和.则下列说法中,错误的是( )| A、CH3COOH溶液的浓度为0.1mol?L-1 |
| B、图中点①到点③所示溶液中,水的电离程度先增大后减小 |
| C、点④所示溶液中存在:c(CH3COOH)+c(H+)=c(CH3COO-)+c(OH-) |
| D、滴定过程中的某点,会有c(Na+)>c(CH3COO-)=c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MgCO3可以转化为Mg(OH)2,则Ksp{Mg(OH)2}>Ksp(MgCO3) | ||
B、0.1ml/LNaHSO3溶液的pH为4.0,其溶液中离子浓度大小顺序为:c(Na+)>c(H+)>c(HSO
| ||
C、向pH=2的醋酸溶液中加入水稀释后,溶液中
| ||
| D、向次氯酸钙溶液中通入少量SO2反应的离子方程式为:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应I 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应II 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com