
【题目】有一酸性溶液可能含有Br-、SO42-、H2SO3、NH4+ 等微粒,对该酸性溶液分别进行实验:
(1)加热,放出的气体可以使品红溶液褪色;
(2)取原溶液加碱,调至溶液呈碱性,加热,放出的气体能使湿润的红色石蕊试纸变蓝;
(3)取原溶液加氯水,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列微粒不能确认其在原溶液中是否存在的是![]()
![]()
![]()
A.SO42-B.Br-C.H2SO3D.NH4+
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】向100mL的FeBr2溶液中通入标准状况下的C12 3.36 L后,C12全部被还原,并且测得溶液中c(Br–)=c(Cl–),则原FeBr2溶液的物质的量浓度是
A.3mol/LB.2mol/ LC.1.5 mol/ LD.0.75mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①金属氧化物一定是碱性氧化物 ②碱性氧化物一定是金属氧化物
③酸性氧化物一定是非金属氧化物 ④非金属氧化物不一定是酸性氧化物
⑤能电离出![]() 的化合物一定是酸 ⑥
的化合物一定是酸 ⑥![]() 属于一元酸
属于一元酸
⑦含有氧元素的化合物都是氧化物 ⑧酸性氧化物不一定能与水化合生成酸
A.2个B.3个C.4个D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种元素在周期表中的位置如下图所示,已知A、B、C原子序数之和为37。下列关于A、B、C三种元素的说法正确的是
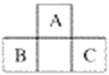
A. 元素B和C位于第四周期 B. 元素A的原子序数为7
C. 元素B最外层有5个电子 D. 元素C位于第三周期ⅤA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

(1)装置A的分液漏斗中盛装的试剂是____________,烧瓶中发生的反应的化学方程式是______________________。
(2)画出虚线框内的实验装置图,所加试剂为____________,该装置的作用是__________________。
(3)装置B中盛放的试剂是____________(填序号),实验现象为____________________________,该反应的离子方程式是____________________________,该反应属于四种基本反应类型中的__________反应。
A.Na2S溶液 B.Na2SO3溶液
C.Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸的酸性比硫酸强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气在加热条件下反应生成三氯化铁,铁与硫在加热条件下反应生成硫化亚铁;⑦硫原子与氯原子的电子层数相同,氯的原子半径小于硫原子。能说明氯的非金属性比硫强的是________(填序号)。
A.全部 B.②③④⑥⑦
C.①②④⑤⑥ D.②③④⑤⑥⑦
(5)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,写出该装置中所发生反应的离子方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠是一种剧毒物质,工业上常用硫代硫酸钠溶液处理废水中的氰化钠。硫代硫酸钠的工业制备原理为:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2 。某化学兴趣小组拟用该原理在实验室制备硫代硫酸钠,并检测氰化钠废水处理排放情况。
I.实验室通过如图所示装置制备Na2S2O3
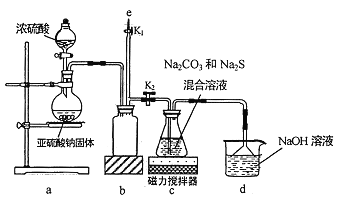
(1)实验中要控制SO2生成速率,可采取的措施有_____________(写出一条)。
(2)b装置的作用是_____________ 。
(3)反应开始后,c 中先有淡黄色浑浊产生,后又变为澄清,此浑浊物为__________(填化学式)。
(4)实验结束后,在e处最好连接盛__________(填“NaOH 溶液”、“水”、“CCl4”中的一种) 的注射器,接下来的操作为______________,最后拆除装置。
II.氰化钠废水处理
(5)已知: a.废水中氰化钠的最高排放标准为0.50mg/L;
b.Ag++2CN-==[Ag(CN)2]-,Ag++I-=AgI↓,AgI 呈黄色,且CN-优先与Ag+反应。
实验如下: 取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
①滴定时1.00×10-4mol/L的标准AgNO3溶液应用________(填仪器名称) 盛装; 滴定终点时的现象是______________。
②处理后的废水是否达到排放标准_______(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如下图所示:

(1)25℃时水的电离平衡曲线应为______(选填“A”或“B”);
(2)25℃时,将pH=9的NaOH溶液与pH=4的盐酸溶液混合,若所得混合溶液的pH=7,则NaOH溶液与盐酸溶液的体积比为________;
(3)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则混合前,a与b之间应满足的关系是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) KClO3+ 6HCl (浓)=3Cl2 ↑+KCl +3H2O其中氧化剂为______;还原产物为_______;氧化产物与还原产物的质量比为_________; 浓盐酸在反应中表现出来的性质是 ________ (填写编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)用双线桥法标出以上反应的电子转移的方向和数目___________
(3)Fe(OH)3胶体的制备:取一小烧杯,加入25 mL蒸馏水,加热至沸腾,然后向沸水中逐滴加入5 ~ 6滴___________,继续煮沸至体系呈______________,停止加热,即制得Fe(OH)3胶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)醇的官能团的名称是_____。
(2)某气态有机物相对于氢气的密度为14,则其结构简式为_____。
(3)某有机物的结构简式如图所示,则其一氯代物共有_____种。

(4)新戊烷用系统命名法命名应为_____。
(5)分别将等物质的量的C3H8、C4H8完全燃烧,消耗氧气质量多的是_____(填分子式)。
(6)下列最简式中,只能代表一种有机物的有_____(选填对应的序号)。
①CH3 ②CH2 ③CH2O ④CH4O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com