
羟基磷灰石是一种重要的生物无机材料,其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:在剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。
3种钙盐的溶解度随溶液pH的变化如图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
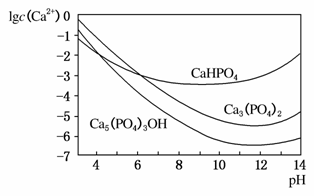
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3·H2O===Ca5(PO4)3OH↓+________+________。
②5Ca(OH)2+3H3PO4===______________________________。
(2)与方法A相比,方法B的优点是_______________________。
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是_______________________________________________。
(4)图中所示3种钙盐在人体中最稳定的存在形式是________________(填化学式)。
科目:高中化学 来源: 题型:
下列对于生活垃圾中生物质能的利用不合理的是( )
A.将生活垃圾进行处理后焚烧,利用产生的热能发电
B.将生活垃圾进行生物化学转换制得CH4
C.将生活垃圾拉到农村找个地方掩埋
D.让生活垃圾在一定条件下发生化学反应,产生热值较高的可燃气体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电解质溶液的有关叙述正确的是( )
A.同浓度,同体积的强酸与强碱溶液混合后,溶液的pH=7
B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
C.含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中c(K+)=c(HCO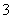 )
)
D.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
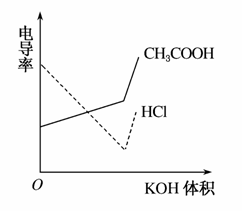
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。右图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
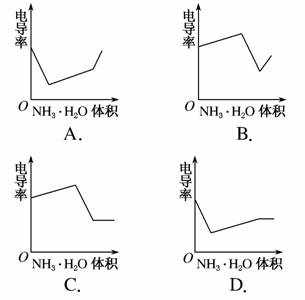
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,对于可逆反应X(g)+3Y(g)2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断不合理的是( )
A.c1c2=13
B.平衡时,Y和Z的生成速率之比为23
C.X和Y的转化率相等
D.c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:

25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
Sn(s)+Pb2+(aq)Sn2+(aq)+Pb(s)
体系中c(Pb2+)和c(Sn2+)变化关系如图所示。
下列判断正确的是( )
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
D.25 ℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热ΔH为-57.3 kJ/mol,辛烷的标准燃烧热为-5 518 kJ/mol。下列热化学方程式书写正确的是( )
A.2H+(aq)+SO (aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) ΔH=-57.3 kJ/mol
(aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) ΔH=-57.3 kJ/mol
B.KOH(aq)+ H2SO4(aq)===
H2SO4(aq)=== K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
C.C8H18(l)+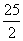 O2(g)===8CO2(g)+9H2O(g) ΔH=-5 518 kJ/mol
O2(g)===8CO2(g)+9H2O(g) ΔH=-5 518 kJ/mol
D.2C8H18(g)+25O2(g)===16CO2(g)+18H2O(l) ΔH=-5 518 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个氧化还原反应体系中反应物、生成物共六种粒子,Fe3+、NO 、Fe2+、NH
、Fe2+、NH 、H+、H2O,下列叙述正确的是 ( )。
、H+、H2O,下列叙述正确的是 ( )。
A.该反应说明Fe(NO3)2溶液不宜加酸酸化
B.该反应中氧化剂与还原剂物质的量之比为8∶1
C.若有1 mol NO 发生氧化反应,转移电子5 mol
发生氧化反应,转移电子5 mol
D.若将该反应设计成原电池,则负极反应为Fe3++e-===Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com