
| A. | Fe2O3+3CO═2Fe+3CO2△H=-24.8 kJ•mol-1(反应热) | |
| B. | CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9 kJ•mol-1(反应热) | |
| C. | C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(g)△H=-2 658.0 kJ•mol-1(燃烧热) | |
| D. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.3 kJ•mol-1(中和热) |
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素Y、W的简单阴离子具有相同的电子层结构 | |
| B. | 由X、W两种元素组成的化合物是离子化合物 | |
| C. | X的简单气态氢化物的热稳定性比W的弱 | |
| D. | 离子半径:r(Z)<r(Y)<r(X)<r(W) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10.7 | B. | 8.5 | C. | 9.6 | D. | 10.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/L | B. | 0.1mol/L | C. | 0.05mol/L | D. | 0.02 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
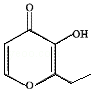 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )| A. | 该有机物的分子式为C7H7O3 | |
| B. | 1mol该有机物最多能与2mol H2发生加成反应 | |
| C. | 该有机物能发生取代、加成和氧化反应 | |
| D. | 该有机物的一种含苯环的同分异构体能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑥⑦⑧ | B. | ③⑥⑧ | C. | ④⑥⑦ | D. | ④⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 组别 | KMnO4溶液 /ml | H2C2O4溶液 /ml | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 8.00 | 5.00 | 3.00 | 20 | |
| Ⅱ | 8.00 | 5.00 | 3.00 | 30 | |
| Ⅲ | 8.00 | 5.00 | 1.00 | 20 | 2.00mL 蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | X | T | Y | Z | W | M | N |
| 主要化合价 | +1 | -2 | -1 | +1 | +2 | +2、-2 | +7、-1 |
| 结构或用途 | 原子半径最小 | 地壳中含量最高的元素 | 非金属性最强 | 一种含氧化物可用作供氧剂 | 次外层电子数是最外层电子数的4倍 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com