
分析 (1)D的浓度变化量为2mol÷2L=1mol/L,根据v=$\frac{△c}{△t}$计算v(D);
(2)利用速率之比等于化学计量数之比计算x;
(3)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
(4)由方程式可知参加反应的n(A)=$\frac{3}{2}$n(D),再根据转化率定义计算A的转化率.
解答 解:(1)D的浓度变化量为2mol÷2L=1mol/L,则v(D)=$\frac{1mol/L}{5s}$=0.2mol/(L.s),
答:5s内D的平均反应速率为0.2mol/(L.s);
(2)速率之比等于化学计量数之比,则x:2=0.4mol/(L.s):0.2mol/(L.s),解得x=4,
答:x的值为4;
(3)3A(g)+B(g)?4C(g)+2D(g)的化学平衡常数表达式K=$\frac{{c}^{4}(C)×{c}^{2}(D)}{{c}^{3}(A)×c(B)}$,
故答案为:$\frac{{c}^{4}(C)×{c}^{2}(D)}{{c}^{3}(A)×c(B)}$;
(4)由方程式可知参加反应的n(A)=$\frac{3}{2}$n(D)=$\frac{3}{2}$×2mol=3mol,故A的转化率为$\frac{3mol}{5mol}$×100%=60%,
答:平衡时A的转化率是60%.
点评 本题考查化学反应速率有关、化学平衡计算、化学平衡常数等,难度不大,注意对基础知识的理解掌握.


 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 2:2:3 | C. | 3:3:2 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
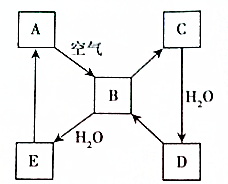 如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、Na+、Al3+、Cu2+ |
| 阴离子 | OH-、HCO3-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉是混合物,漂粉精是纯净物 | |
| B. | 工业上将氯气通入澄清石灰水制取漂白粉 | |
| C. | 漂白粉的有效成分是Ca(ClO)2 | |
| D. | 漂白液的有效成份是Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  装置用于检验消去产物 | B. | 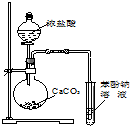 装置检验酸性:盐酸>碳酸>苯酚 | ||
| C. | 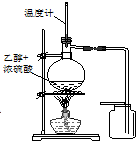 装置用于实验室制取并收集乙烯 | D. | 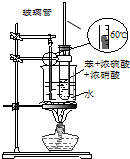 装置用于实验室制硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
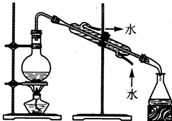
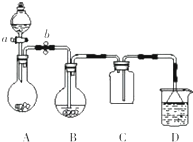 某化学小组设计了如图所示装置.用以探究Cu跟浓H2SO4的反应并收集少量气态产物(加热及夹持装置省略).
某化学小组设计了如图所示装置.用以探究Cu跟浓H2SO4的反应并收集少量气态产物(加热及夹持装置省略).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.用Ca(OH)2和 NH4Cl制取NH3 | B.从碘水中提取碘单质 | C.从食盐水中获取氯化钠 | D.用自来水制取蒸馏水 |
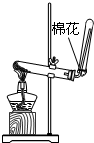 | 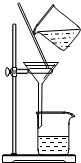 | 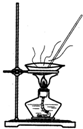 |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com