
| A. | CH3CH2 CH2CH3 | B. | CH3COOCH2CH3 | C. | CH3CH2COOH | D. | CH3CH3 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | |
| 起始时合金粉末的质量/mg | 204 | 399 | 561 |
| 反应结束时生成气体的体积/mL | 224 | 336 | 336 |
| A. | 起始时盐酸的浓度为1mol•L-1 | B. | 加入的NaOH溶液为40mL | ||
| C. | 合金中镁、铝的物质的量相等 | D. | 所得的滤液中含三种阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
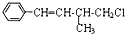
| A. | 该有机物的分子式为C11H13Cl | |
| B. | 该有机物能使溴水褪色 | |
| C. | 该有机物遇硝酸银溶液产生白色沉淀 | |
| D. | 该有机物在一定条件下,能发生消去反应或取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
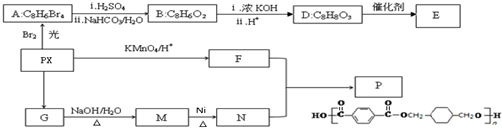
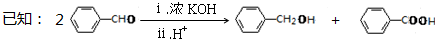

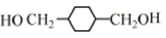 .
. .
.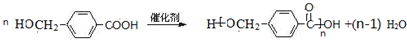 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂不影响反应速率 | B. | 升高体系温度能加快反应速率 | ||
| C. | 减小SO2的浓度能加快反应速率 | D. | 反应中SO2能100%转化为SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
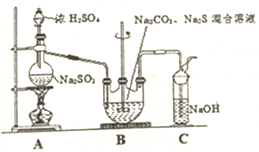 硫代硫酸钠晶体(Na2S203•5H20)俗名“大苏打”.己知它易溶于水,难溶于乙醇,加热和遇酸易分解.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
硫代硫酸钠晶体(Na2S203•5H20)俗名“大苏打”.己知它易溶于水,难溶于乙醇,加热和遇酸易分解.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com