
【题目】(1)按照系统命名法写出下列烷烃的名称:
 _____
_____
 ___
___
 ___
___
 _____
_____
(2)根据下列有机物的名称,写出相应的结构简式:
①2,4二甲基戊烷_________________________
②2,2,5三甲基3乙基己烷__________________________
【答案】3,3,4,6四甲基辛烷 3,3,5三甲基庚烷 4甲基3乙基辛烷 3,3,4三甲基己烷 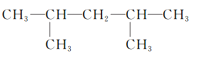
【解析】
(1)①此有机物最长碳链为8,在3号碳上含有2个甲基,在4号碳上含有1个甲基,在6号碳上含有1个甲基,正确命名为:3,3,4,6四甲基辛烷,故答案为:3,3,4,6四甲基辛烷。
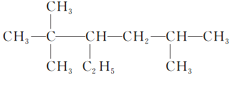
②此有机物最长碳链为9,在3号碳上含有2个甲基,在5号碳上有1个甲基,正确命名为:3,3,5三甲基庚烷,故答案为:3,3,5三甲基庚烷。
③此有机物最长碳链为8,在3号碳上含有1个乙基,在4号碳上含有1个甲基,正确命名为:4甲基3乙基辛烷故答案为:4甲基3乙基辛烷。
④此有机物最长碳链为6,在3号碳上含有2个甲基,在4号碳上含有1个甲基,正确命名为:3,3,4三甲基己烷,故答案为:3,3,4三甲基己烷。
(2)①2,4二甲基戊烷,主链有5个碳原子,2号、4号碳上各有一个甲基,结构简式为: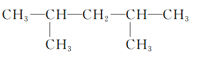 ,故答案为:
,故答案为: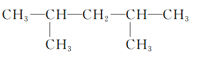 。
。
②2,2,5三甲基3乙基己烷,主链有6个碳原子,2号碳上有二个甲基,5号碳上有一个甲基,3号碳上有一个乙基,结构简式为: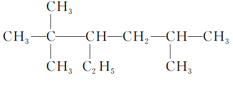 ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】下图表示溶液中c(H+)和c(OH﹣)的关系,下列判断错误的是

A. 两条曲线间任意点均有c(H+)×c(OH﹣)=KW
B. M区域内任意点均有c(H+)<c(OH﹣)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0 molPCl3和1.0 molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:
PCl3(g)+ Cl2(g)![]() PCl5(g)达到平衡时, PCl5为0.40 mol,如果此时移走1.0 molPCl3和0.50 molCl2,在相同温度下再达平衡时 PCl5的物质的量是
PCl5(g)达到平衡时, PCl5为0.40 mol,如果此时移走1.0 molPCl3和0.50 molCl2,在相同温度下再达平衡时 PCl5的物质的量是
A. 0.40 mol B. 小于0.20 mol C. 0.20 mol D. 大于0.20 mol,小于0.40 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识的回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为____________________________。
(2)B为0.1 mol·L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方程式表示):________________________________________________________________________________________________________________________________________________;实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因:_________________________。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入盐酸目的是________________________________________。若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程为___________________________________。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:AgCl(S) ![]() Ag+(aq)+ Cl-(aq),在25℃时,氯化银的Ksp = 1.8×10-10mol2·L-2。现将足量氯化银分别放入:①100mL蒸馏水中;②100mL 0.2 mol·L-1AgNO3溶液中;③100mL 0.1 mol·L-1氯化铝溶液中;④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是____________(填写序号)
Ag+(aq)+ Cl-(aq),在25℃时,氯化银的Ksp = 1.8×10-10mol2·L-2。现将足量氯化银分别放入:①100mL蒸馏水中;②100mL 0.2 mol·L-1AgNO3溶液中;③100mL 0.1 mol·L-1氯化铝溶液中;④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是____________(填写序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,同体积的S18O2和硫化氢气体(H2S)的物质的量之比为_____,质量之比为_____;同温同压下,等质量的S18O2和H2S的密度之比为_____;
(2)现有0.2mol/L的BaCl2溶液,则2L该溶液中含有_____molBa2+;3L该溶液中,Cl﹣的物质的量浓度是_____mol/L,将原溶液取出10mL,稀释到250mL,则所得溶液的物质的量浓度是_____mol/L,向该溶液加入200mL硫酸溶液,恰好将此溶液中的钡离子完全沉淀,则该硫酸溶液的物质的量浓度是_____mol/L,将沉淀过滤后洗涤干燥并称量,所得固体的质量是_____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸锂电池应用广泛, 电池放电后负极材料主要含有Li4Ti5O12、 铝箔及少量Fe, 可通过下列工艺流程回收钛、 锂。回答下列问题:

(1) Li4Ti5O12中, Ti元素的化合价为___, 滤液1中含金属的阴离子是___(填离子符号)。
(2) 酸浸时 Li4Ti5O12发生的反应是: Li4Ti5O12+7H2SO4+5H2O2=2Li2SO4+5[TiO(H2O2)]SO4+7H2O, 该反应是否属于氧化还原反应?___(填 “是” 或 “否”); 滤渣1是___。
(3) 向[TiO(H2O2)]SO4溶液中加入Na2SO3溶液发生反应的离子方程式为___。
(4) 向TiOSO4溶液中通入NH3发生反应的离子方程式为___。
(5) 沉淀TiO(OH)2用蒸馏水洗涤的目的是___。
(6) 萃取时, 温度对萃取率的影响如图所示。由图分析知实验时选择在常温下进行即可, 理由是__。

(7)“萃取” 和 “反萃取” 可简单表示为:[TiO(H2O2)]2++2(HA)2![]() [TiO(H2O2)](HA2)2+2H+,则反萃取过程中加入的试剂X是___。
[TiO(H2O2)](HA2)2+2H+,则反萃取过程中加入的试剂X是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有A,B两种元素,A的+1价阳离子与B的-2价阴离子的电子层结构与氖相同。
(1)用电子式表示A与B两种元素构成的两种化合物分别为__________________和__________________,前者只有__________键;后者既有________键,又有________键。
(2)A的氢化物的电子式为_______,其中含有________键,它与水反应的化学方程式为____________。
(3)元素B的气态氢化物的电子式为___________________________________________,该分子中的键属于________(填“极性”或“非极性”)键,该氢化物与H+形成的键属于________。
(4)元素A的最高价氧化物的水化物的电子式为____________,其中既有________键,又有________键。
(5)B元素的单质有__________和__________,二者互称为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中,有一个左右可滑动隔板,两边分别进行可逆反应,各物质的量如下:M、N、P为2.5mol、3.0mol、1.0mol。A、C、D各为0.50mol,B的物质的量为x,当x的物质的量在一定范围内变化,均可以通过调节反应器的温度,使两侧反应均达到平衡,且隔板在反应器的正中位置。达到平衡后,测得M的转化率为75%,填写空白:
![]()
(1)达到平衡后,反应器左室气体总的物质的量为____________________mol。
(2)若要使右室反应开始时V正>V逆,x的取值范围_____________________。
(3)若要使右室反应开始时V正<V逆,x的取值范围_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用钢铁厂烟灰(含Fe、Mn、SiO2,少量的Al2O3、CaO及MgO)制备MnCO3的工艺流程如下:
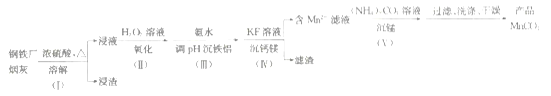
已知25℃时,下列难溶物的溶度积常数:
难溶物 | CaF2 | MgF2 | MnCO3 | Mn(OH)2 |
Ksp | 4.0×10-11 | 6.4×10-9 | 2.2×10-11 | 1.9×10-13 |
回答下列问题:
(1)步骤(Ⅰ)浸渣的主要成分是______________(填化学式)。
(2)步骤(Ⅱ)加H2O2溶液时反应的离子方程式为________________;
加氨水调节pH沉铁铝时,步骤(Ⅲ)应调节的pH适宜范围为____________。(部分金属离子开始沉淀与沉淀完全的pH范围如下)
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Mg2+ |
沉淀pH范围 | 7.6~9.6 | 2.7~3.7 | 3.4~5.2 | 8.3~9.3 | 9.6~11.1 |
(3)步骤(Ⅳ)用KF溶液沉钙镁时,要使c(Ca2+)、c(Mg2+)均小于1×10-6mol·L-1,则应控制反应液中c(F-)>___________mol·L-1;反应MgF2(s)+Ca2+![]() CaF2(s)+Mg2+的平衡常数K=___________。
CaF2(s)+Mg2+的平衡常数K=___________。
(4)步骤Ⅴ沉锰时,在60℃按投料比n[(NH4)2CO3]/n(Mn2+)=2,溶液的pH对MnCO3产率的影响如图所示;pH=7,按投料比n[(NH4)2CO3]/n(Mn2+)=2,反应温度对MnCO3产率的影响如图所示。
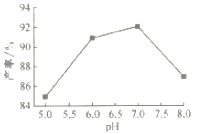
①上图中,在pH<7.0时,pH越小产率____________(填“越高”或“越低”;在pH>7.0时,pH越大产率越低且纯度也降低,其原因是___________________。

②上图中,温度高于60℃时,温度越高产率越低且纯度也越低,主要原因是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com