
 用如图所示的装置进行电解,在通电一段时间后,铁电极的质量增加.
用如图所示的装置进行电解,在通电一段时间后,铁电极的质量增加.分析 (1)装置是电解池,通电一段时间后发现乙烧杯中铁电极的质量增加,铁做电解池阴极,银做阳极;
(2)甲烧杯中和铁连接的为阳极,左边的碳棒是阴极,电解硫酸铜溶液生成铜、氧气和硫酸;
(3)阳极电极反应和电子守恒计算电极产物或电解溶解的物质的量.
解答 解:(1)通电一段时间后发现乙烧杯中铁电极的质量增加,铁做电解池阴极,银做阳极,电解质溶液是硝酸银溶液,所以原理是电镀原理,阴极电极反应为:Ag++e-=Ag;阳极电极反应为:Ag-e-=Ag+,故答案为:Ag++e-=Ag;Ag-e-=Ag+;
(2)甲烧杯中和铁连接的为阳极,左边的碳棒是阴极,电解硫酸铜溶液生成铜、氧气和硫酸,电池反应为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,
故答案为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4;
(3)甲中阴极电极反应为2Cu2++4e-=2Cu,阳极电极反应为4OH--4e-=2H2O+O2↑;乙池中电极反应,阳极电极反应为4Ag-4e-=4Ag+;阴极电极反应为4Ag++4e-=4Ag;依据电子守恒计算得到,由左到右碳-碳-铁-银四个是极上析出或溶解物质的物质的量之比是2:1:4:4,故答案为:2:1:4:4.
点评 本题考查了电解池原理的应用,主要是电极判断,电极反应,电极产物的分析判断,电子守恒的计算应用,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;B+G→F
;B+G→F +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Mg(OH)2 | CaCO3 | MgCO3 | Ca(OH)2 | CaSO4 | MgSO4 |
| 溶解度(g/100g H2O) | 9.0×10-4 | 1.5×10-3 | 1.0×10-2 | 1.7×10-1 | 2.0×10-1 | 26.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为酸性HF>HCl,所以非金属性F>Cl | |
| B. | 因为SO2、Cl2都有漂白性,所以二者混合使用漂白有色物质,效果会更好 | |
| C. | 因为某物质的焰色反应呈黄色,所以其一定是含Na元素的化合物 | |
| D. | 因为烯烃的通式为CnH2n,不同烯烃的实验式相同,所以烯烃的含碳量为一常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KI的酸性溶液长期置于空气中:4I-+4H++O2═2I2+2H2O | |
| B. | 高锰酸钾酸性溶液与草酸溶液反应:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| C. | 用稀硫酸除去铁片表面的铁锈:Fe2O3+6H+═2Fe3++3H2O | |
| D. | 硫代硫酸钠溶液中滴加稀硫酸:2H++S2O32-═S↓+SO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯分子的比例模型示意图: | B. | 乙醇的分子式:CH3CH2OH | ||
| C. | 2-甲基-2-丁烯的键线式: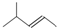 | D. | 硫化钠Na+[:$\underset{\stackrel{..}{S}}{..}$:]2Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com