
 (Ⅰ)已知四种无机化合物在水中和液氨中的溶解度(g/100g溶剂)为:
(Ⅰ)已知四种无机化合物在水中和液氨中的溶解度(g/100g溶剂)为:| 物质 20℃时溶解度(g/100g溶解) |
AgNO3 | Ba(NO3)2 | AgCl | BaCl2 |
| 水中 | 216 | 9.02 | 1.9×10-14 | 35.8 |
| 液氨 | 86 | 97.2 | 0.8 | 0 |
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2mol A2、1mol BC | 1mol X | 4mol A2、2mol BC |
| 平衡时n(X) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
| 1mol |
| 2L |
| 2mol |
| 2L |
| 0.5mol |
| 2L |
| 0.25 |
| 0.25×0.52 |
| 1-a |
| 1 |


科目:高中化学 来源: 题型:
| A、电解食盐水若产生2g氢气,则转移的电子数目为2NA |
| B、200mL 1mol/L Al2(SO4)3溶液中,Al3+和SO42-总数为NA |
| C、在标准状况下,含4n mol HCl浓盐酸与足量的MnO2反应生成Cl2分子的个数等于nNA |
| D、6g金刚石所含碳碳键数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4HSO3溶于过量的NaOH溶液中:HSO3-+OH-=SO32-+H2O |
| B、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| C、Fe3O4与稀硝酸反应:Fe3O4+8H+=2Fe3++Fe2++4H2O |
| D、酸性KMnO4溶液与双氧水溶液反应:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.| 1 |
| 2 |
| 3 |
| 2 |


查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
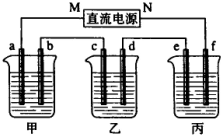 如图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g5.00%nNaOH溶液、足量的CuSO4溶液和100g9.55%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.00%,乙中c电极质量增加,据此回答问题:
如图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g5.00%nNaOH溶液、足量的CuSO4溶液和100g9.55%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.00%,乙中c电极质量增加,据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 环境 |  |
 |
 |
 |
| 行为 | 切勿随意进入 | 严禁烟火 | 尽量远离 | 顺风向低处跑 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com