
 Ąė×ÓČēĻĀ±ķ£ŗ
Ąė×ÓČēĻĀ±ķ£ŗ| æÉÄÜ“óĮæŗ¬ÓŠµÄŃōĄė×Ó | H+ NH4+ Al3+ K+ |
| æÉÄÜ“óĮæŗ¬ÓŠµÄŅõĄė×Ó | Cl- Br- I? ClO? AlO2- |
 £©Óė¼ÓNaOHČÜŅŗµÄĢå»ż£Ø
£©Óė¼ÓNaOHČÜŅŗµÄĢå»ż£Ø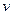 £©µÄ¹ŲĻµČēÓŅĶ¼ĖłŹ¾”£ŌņøĆČÜŅŗÖŠČ·¶Øŗ¬ÓŠµÄĄė×ÓÓŠ_______________£»
£©µÄ¹ŲĻµČēÓŅĶ¼ĖłŹ¾”£ŌņøĆČÜŅŗÖŠČ·¶Øŗ¬ÓŠµÄĄė×ÓÓŠ_______________£»
 ¹ŲĻµČēĻĀ±ķĖłŹ¾£¬·ÖĪöŗó»Ų“šĻĀĮŠĪŹĢā£ŗ
¹ŲĻµČēĻĀ±ķĖłŹ¾£¬·ÖĪöŗó»Ų“šĻĀĮŠĪŹĢā£ŗ| Cl2µÄĢå»ż£Ø±ź×¼×“æö£© | 2.8L | 5.6 L | 11.2 L |
 £ØCl££© £ØCl££© | 1.25mol | 1.5 mol | 2 mol |
 £ØBr££© £ØBr££© | 1.5 mol | 1.4 mol | 0.9 mol |
 £ØI££© £ØI££© | 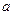 mol mol | 0 | 0 |
 ¾«Ó¢æŚĖćæØĻµĮŠ“š°ø
¾«Ó¢æŚĖćæØĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®¼ÓČėĻ”ĻõĖįŗó£¬ŌŁ¼ÓČėAgNO3ČÜŅŗ£¬ÓŠ°×É«³ĮµķÉś³É£¬ŌņĖµĆ÷ŌČÜŅŗÖŠŗ¬ÓŠCl- |
| B£®¼ÓČėKSCNČÜŅŗĪŽŗģÉ«³öĻÖ£¬ŌŁ¼ÓČėĀČĖ®ČÜŅŗ±äŃŖŗģÉ«£¬ĖµĆ÷ŌČÜŅŗÖŠŅ»¶Øŗ¬ÓŠFe2+ |
| C£®¼ÓČėÓĆĻ”ĻõĖįĖį»ÆµÄBa£ØNO3£©2ČÜŅŗ²śÉś°×É«³Įµķ£¬ŌņæÉĶʶĻŌČÜŅŗÖŠŅ»¶Øŗ¬ÓŠSO42- |
| D£®¼ÓČėŃĪĖį²śÉśŹ¹³ĪĒåŹÆ»ŅĖ®±ä»ė×ĒµÄĪŽÉ«ĪŽĪ¶µÄĘųĢ壬æÉĶĘ²āŌČÜŅŗÖŠŗ¬ÓŠCO32-Ąė×Ó»ņHCO3- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗŹµŃéĢā
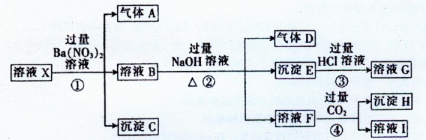
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 MµÄ»ÆŗĻ¼ŪĪŖ£Ø £©
MµÄ»ÆŗĻ¼ŪĪŖ£Ø £©| A£®£«2”””” | B£®£«3”””” | C£®£«4”””” | D£®£«6 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 H++A2££¬ÓÖÖŖ0.1mol”¤L£1NaHAČÜŅŗµÄpH = 2”£ŌņĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
H++A2££¬ÓÖÖŖ0.1mol”¤L£1NaHAČÜŅŗµÄpH = 2”£ŌņĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ HA£+OH££¬ĖłŅŌNa2AČÜŅŗĻŌ¼īŠŌ
HA£+OH££¬ĖłŅŌNa2AČÜŅŗĻŌ¼īŠŌ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®H+ | B£®HC03Ņ» | C£®OH- | D£®Ag+ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com