
【题目】砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。
(1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有![]() ,其原因是_______________________________。
,其原因是_______________________________。
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题20图- 1和题20图- 2所示。
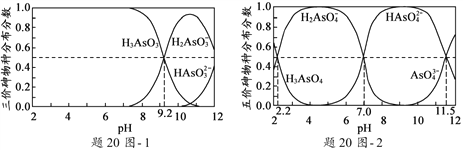
①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为__________________。
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,则pKa1=______(p Ka1 = -lg Ka1 )。
H2AsO4-+H+的电离常数为Ka1,则pKa1=______(p Ka1 = -lg Ka1 )。
(3)溶液的pH对吸附剂X表面所带电荷有影响。pH =7.1时, 吸附剂X表面不带电荷; pH > 7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如题20图-3所示。

①在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是______________。
②在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为___________。 提高吸附剂X对三价砷去除效果可采取的措施是_________________________________。
【答案】 碱性溶液吸收了空气中的CO2 OH- + H3AsO3![]() H2AsO3- + H2O 2.2 在pH7~9之间,随pH升高H2AsO4-转变为HAsO42-,吸附剂X表面所带负电荷增多,静电斥力增加 在pH4~7之间,吸附剂X表面带正电,五价砷主要以H2AsO4-和HAsO42-阴离子存在,静电引力较大;而三价砷主要以H3AsO3分子存在,与吸附剂X表面产生的静电引力小 加入氧化剂,将三价砷转化为五价砷
H2AsO3- + H2O 2.2 在pH7~9之间,随pH升高H2AsO4-转变为HAsO42-,吸附剂X表面所带负电荷增多,静电斥力增加 在pH4~7之间,吸附剂X表面带正电,五价砷主要以H2AsO4-和HAsO42-阴离子存在,静电引力较大;而三价砷主要以H3AsO3分子存在,与吸附剂X表面产生的静电引力小 加入氧化剂,将三价砷转化为五价砷
【解析】(1)NaOH在空气中易与CO2反应生成NaCO3,吸附剂X中含有![]() ,其原因是碱性溶液吸收了空气中的CO2 ;(2)①从题20图-1可知pH由小变大时, H3AsO3浓度减小,H2AsO3-浓度增大,当溶液由无色变为浅红色时,主要反应的离子方程式为OH- + H3AsO3
,其原因是碱性溶液吸收了空气中的CO2 ;(2)①从题20图-1可知pH由小变大时, H3AsO3浓度减小,H2AsO3-浓度增大,当溶液由无色变为浅红色时,主要反应的离子方程式为OH- + H3AsO3![]() H2AsO3- + H2O ;②H3AsO4第一步电离方程式H3AsO4
H2AsO3- + H2O ;②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,Ka1=
H2AsO4-+H+的电离常数为Ka1,Ka1=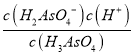 ,由题20图-2读出:,
,由题20图-2读出:, ![]() =
= ![]() ,
, ![]() =10-2.2mol/L,Ka1=
=10-2.2mol/L,Ka1= ![]() =10-2.2mol/L,p Ka1 = -lg Ka1 =-lg10-2.2=2.2;(3)①在pH7~9之间,随pH升高H2AsO4-转变为HAsO42-,吸附剂X表面所带负电荷增多,,静电斥力增加,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降。②在pH4~7之间,吸附剂X表面带正电,五价砷主要以H2AsO4-和HAsO42-阴离子存在,静电引力较大;而三价砷主要以H3AsO3分子存在,与吸附剂X表面产生的静电引力小。提高吸附剂X对三价砷去除效果可采取的措施是:加入氧化剂,将三价砷转化为五价砷。
=10-2.2mol/L,p Ka1 = -lg Ka1 =-lg10-2.2=2.2;(3)①在pH7~9之间,随pH升高H2AsO4-转变为HAsO42-,吸附剂X表面所带负电荷增多,,静电斥力增加,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降。②在pH4~7之间,吸附剂X表面带正电,五价砷主要以H2AsO4-和HAsO42-阴离子存在,静电引力较大;而三价砷主要以H3AsO3分子存在,与吸附剂X表面产生的静电引力小。提高吸附剂X对三价砷去除效果可采取的措施是:加入氧化剂,将三价砷转化为五价砷。


科目:高中化学 来源: 题型:
【题目】某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。
查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O
探究一:用如图所示装置进行实验,回答下列问题:

(1)仪器组装完成后,夹好止水夹,_____,则说明装置A的气密性良好.
(2)装置A是氢气的发生装置,可以选用的药品是________(填选项)
A.稀硫酸和锌片B.稀硝酸和铁片 C.氢氧化钠溶液和铝片D.浓硫酸和镁片
(3)从下列实验步骤中,选择正确的操作顺序:①________③(填序号).
①打开止水夹②熄灭C处的酒精喷灯 ③C处冷却至室温后,关闭止水夹
④点燃C处的酒精喷灯 ⑤收集氢气并验纯⑥通入气体一段时间,排尽装置内的空气
探究二:
(4)甲同学取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,则说明样品中不含Cu2O;乙同学认为观点不正确,其原因是_____________;丙同学另取少量样品于试管中,加入适量的浓硝酸,产生红棕色的气体.证明样品中一定含有________,其反应的离子方程式为_____;丁同学预设计实验证明另一种物质是否存在,其方案为__________。
(5)取一定量样品于烧杯中,加入足量的稀硫酸,若反应后经过滤得到固体3.2g,滤液中Fe2+有1.0mol,则样品中n(Cu2O)=_________mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的认识不正确的是
A. 油脂在空气中完全燃烧转化为水和二氧化碳
B. 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C. 在水溶液里,乙酸分子中的—CH3可以电离出H+
D. 在浓硫酸存在下,苯与浓硫酸共热生成硝基苯的反应属于取代反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱硝技术是处理氮氧化物的有效方法之一。在1L的恒容密闭容器中充入2mol NH3、1mol NO和1mol NO2,发生反应:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g)△H。在不同温度下发生上述反应,测得N2的物质的量(mol)与时间的关系如下表:
2N2(g)+3H2O(g)△H。在不同温度下发生上述反应,测得N2的物质的量(mol)与时间的关系如下表:
0 | 10 min | 20 min | 30 min | 40 min | |
T1K | 0 | 0.6 | 1.1 | 1.5 | 1.5 |
T2K | 0 | 0.8 | 1.4 | 1.4 | 1.4 |
回答下列问题:
(1)上述反应中___________(填字母)。
A. △S>0,△H>0 B. △S>0,△H<0 C. △S<0,△H>0 D. △S<0,△H<0
(2)T1_______(填“>”“<”或“=”)T2,理由是___________________________________________
(3)T1K下,0~20min内v(NO)=______________
(4)T2K下,NO2的平衡转化率为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时,向10mL0.10mol·L-1的一元弱酸HA(Ka =1.0×10-3)中逐滴加入0.10mol·L-1NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。下列说法正确的是( )
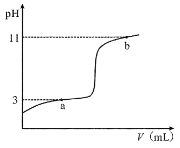
A.a点时,c(HA)+c(OH-)=c(Na+)+c(H+)
B.溶液在a点和b点时水的电离程度相同
C.b点时,c(Na+)=c(HA)+c(A- )+c(OH-)
D.V =10mL时,c(Na+)>c(A-)>c(H+)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在K2Cr2O7溶液中存在下列平衡:2CrO42—(黄色)+2H+![]() Cr2O72—(橙色)+H2O中,溶液颜色介于黄色和橙色之间,今欲使溶液颜色变成黄色,根据勒夏特列原理可以在溶液中加入( )
Cr2O72—(橙色)+H2O中,溶液颜色介于黄色和橙色之间,今欲使溶液颜色变成黄色,根据勒夏特列原理可以在溶液中加入( )
①H+ ②OH- ③K+ ④H2O
A.①③B.②④C.①④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应对雾霾污染、改善空气质量需要从多方面入手,如开发利用清洁能源.甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景.回答下列问题:
(1)![]() 与
与![]() 合成甲醇:
合成甲醇:![]() 但是找到合适的催化剂是制约该方法的瓶颈.目前主要使用贵金属催化剂,但是贵金属储量稀少,成本高昂,难以大规模应用,且使用中存在环境污染的风险.最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现
但是找到合适的催化剂是制约该方法的瓶颈.目前主要使用贵金属催化剂,但是贵金属储量稀少,成本高昂,难以大规模应用,且使用中存在环境污染的风险.最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现![]() 电催化还原制备甲醇方向取得重要进展,该反应历程如图所示.
电催化还原制备甲醇方向取得重要进展,该反应历程如图所示.
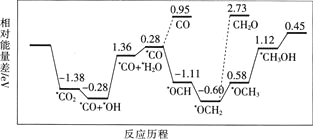
容易得到的副产物有CO和![]() ,其中相对较多的副产物为________________;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中________
,其中相对较多的副产物为________________;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中________![]() 填字母
填字母![]() 的能量变化.
的能量变化.
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(2)恒压![]() 容器的容积可变
容器的容积可变![]() 下,
下,![]() 与
与![]() 在催化剂作用下发生反应
在催化剂作用下发生反应![]()
![]() ,
,![]() 的平衡转化率与温度、压强的关系如图所示.
的平衡转化率与温度、压强的关系如图所示.
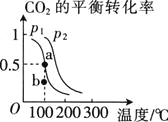
①压强![]() ________
________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() .
.
②在![]() 、
、![]() 条件下,b点时
条件下,b点时![]() ________
________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() .
.
③已知:反应速率![]() ,
,![]() 、
、![]() 分别为正、逆反应速率常数,x为物质的量分数,若b点对应的坐标参数为
分别为正、逆反应速率常数,x为物质的量分数,若b点对应的坐标参数为![]() ,计算b处的
,计算b处的![]() ________
________![]() 保留3位有效数字
保留3位有效数字![]() .
.
(3)焦炭与水蒸气在恒容密闭容器中反应制合成气的主要反应![]() Ⅰ
Ⅰ![]() 、
、![]() Ⅱ
Ⅱ![]() 的
的![]() 为以分压表示的平衡常数
为以分压表示的平衡常数![]() 与T的关系如下图所示.
与T的关系如下图所示.
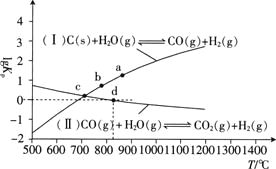
①反应![]() Ⅱ
Ⅱ![]() 的
的![]() ________
________![]() 填“大于”“等于”或“小于”
填“大于”“等于”或“小于”![]() .
.
②![]() 点时,反应
点时,反应![]() 的
的![]() ________
________![]() 填数值
填数值![]() .
.
③在恒容密闭容器中充入![]() 、
、![]() 只发生反应
只发生反应![]() Ⅱ
Ⅱ![]() ,图中d点处达到平衡时,CO的转化率为________;达到平衡时,向容器中再充入
,图中d点处达到平衡时,CO的转化率为________;达到平衡时,向容器中再充入![]() 、
、![]() ,重新达到平衡时,CO的平衡转化率________
,重新达到平衡时,CO的平衡转化率________![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有c(HA)+c(A-)=0.1mol/L的一组HA、KA混合溶液,溶液中c(HA)、c(A-)与pH的关系如下图所示。下列叙述不正确的是 ( )
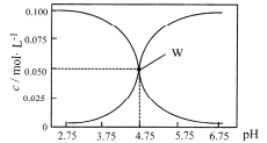
A.pH=5.75的溶液中:c(K+)>c(A-)>c(HA)> c (H+)>c(OH-)
B.欲得W点所示溶液,起始所加溶液应符合c(HA)+c(A-)=0.1mol/L且c(KA)<c(HA)
C.pH=3.75的溶液中:c(K+)+c(H+)-c(OH-)+c(HA)=0.1mol/L
D.若A-的水解常数为Kh,则lgKh=-9.25
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com