
(9分)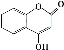 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成:

请回答:
(1)B→C的反应类型是______ ______。D中所含的官能团名称是 。
(2)下列关于化合物G的说法不正确的是__ ___。
a.分子式是C9H6O3
b.不能与金属钠反应
c.分子中含有4种官能团
d.能与液溴反应
e.1 mol G最多能和4mol氢气反应
(3)写出A与银氨溶液反应的化学方程式 。
(4)写出D→E的化学方程式__________________ ___________________。
(9分)
(1)取代反应(1分),羟基、羧基(2分)
(2)b、c (2分)
(3)CH3CHO+2[Ag(NH3)2]OH  CH3COONH4+2Ag↓+3NH3+H2O (2分)
CH3COONH4+2Ag↓+3NH3+H2O (2分)
(4) (2分)

【解析】
试题分析:(1)B是乙酸,C是乙酰氯,所以B生成C的反应是取代反应,Cl原子取代羟基;D中的官能团的名称是羟基、羧基;
(2)根据G的结构简式可知分子式是C9H6O3 ;分子中含有羟基可与与钠、溴反应;含有羟基、酯基、碳碳双键三种官能团;苯环、碳碳双键与氢气发生加成反应,所以1 mol G最多能和4mol氢气反应,所以不正确的是b、c;
(3)A与氧气在催化剂的条件下反应生成乙酸,所以A是乙醛,乙醛与银氨溶液加热反应生成乙酸铵、银、氨气、水,化学方程式为CH3CHO+2[Ag(NH3)2]OH  CH3COONH4+2Ag↓+3NH3+H2O;
CH3COONH4+2Ag↓+3NH3+H2O;
(4)D与甲醇发生酯化反应生成酯和水,化学方程式为
考点:考查有机物的推断,官能团的化学性质,化学方程式的书写


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:选择题
下图小试管内为红墨水,具支试管内盛有pH=4久置的雨水和生铁片。实验观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面。下列说法正确的是
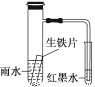
A.生铁片中的碳是原电池的负极,发生还原反应
B.雨水酸性较强,生铁片始终发生析氢腐蚀
C.墨水回升时,碳电极反应式为O2+2H2O+4e-===4OH-
D.具支试管中溶液酸性增强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省焦作市高三上学期期中化学试卷(解析版) 题型:选择题
已知酸性高锰酸钾溶液可以将FeSO4氧化,方程
2KMnO4+10FeSO4+8H2SO4→K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,
现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示。
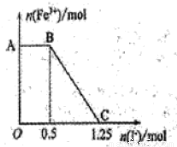
则下列有关说法错误的是
A.图中AB段主要是高锰酸钾和碘化钾溶液反应
B.图中BC段发生的反应为2Fe3++2I-= 2Fe2++ I2。
C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol
D.根据OC段的数据可知开始加入的硫酸亚铁的物质的量为1 mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省汕头市高三上学期期中理综化学试卷(解析版) 题型:填空题
(16分)重铬酸钠(Na2Cr2O7?2H2O)俗称红矾钠,在工业上有广泛的用途。我国目前主要是以铬铁矿(主要成份为FeO?Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
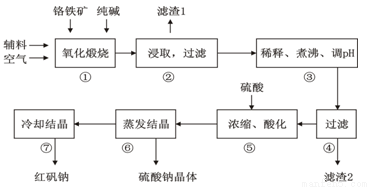
①中涉及的主要反应有:
主反应: 4FeO·Cr2O3+8Na2CO3+7O2 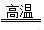 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3  Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3  2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
试回答下列问题:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 。
(2)“③”中调节pH至4.7,目的是 。
(3)“⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式: 。
(4)制取红矾钠后的废水中还含有少量的CrO42-,根据有关标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理可用还原法:
CrO42- Cr3+
Cr3+ Cr(OH)3。绿矾还原CrO42-的离子方程式为:
Cr(OH)3。绿矾还原CrO42-的离子方程式为:
。
用该方法处理10 m3 CrO42-的物质的量浓度为1.5×10-3 mol·L-1的废水,至少需要绿矾(FeSO4?7H2O,相对分子质量为278)的质量是 Kg(保留两位小数)。
步骤⑦的操作是 。为进一步得到较为纯净的红矾钠的操作是
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省汕头市高三上学期期中理综化学试卷(解析版) 题型:选择题
以下进行性质比较的实验设计,合理的是
A.用NaOH溶液与FeCl3溶液制备Fe(OH)3胶体
B.比较氯、溴非金属性:氯气通入溴化钠溶液中
C.将混有SO2的CO2通入NaOH溶液中除去SO2
D.比较镁、铝金属性:镁、铝(除氧化膜)分别放入4mol·L-1NaOH溶液中
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:选择题
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是
A.参加反应的硝酸的物质的量为0.4mol
B.加入合金的质量可能为9.6g
C.沉淀完全时消耗NaOH溶液体积为150mL
D.溶解合金时产生NO气体体积0.224L(以标准状况)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:选择题
在体积固定的密闭容器中进行可逆反应2NO2 2NO+O2,下列能作为反应达到平衡状态标志的是
2NO+O2,下列能作为反应达到平衡状态标志的是
①单位时间内生成nmol O2的同时生成2n mol NO2
②单位时间内生成n mol O2 的同时生成2n mol NO
③用NO2 、NO、O2表示的反应速率之比为2∶2∶1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
⑥混合气体的压强不再改变
⑦混合气体的平均相对分子质量不再改变
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8960 mL的NO2气体和672 mLN2O4的气体(都已折算到标准状态),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为17.02g。则x等于
A.8.64g B.9.44g C.9.00g D.9.20g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期第二次模考试化学试卷(解析版) 题型:选择题
常温下单质硫主要以S8形式存在。加热时,S8会转化为S6、S4、S2等。当温度达到750℃时,硫蒸气主要以S2形式存在(占92%)。下列说法中正确的是
A.S8转化为S6、S4、S2属于物理变化
B.不论哪种硫分子,完全燃烧时都生成SO2
C.S8、S6、S4、S2均属于共价化合物
D.把硫单质在空气中加热到750℃即得S2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com