
【题目】设NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.1.0L0.1mol·L-1乙酸钠溶液中,CH3COO-数目为0.1NA
B.11.2L(标准状况)正戊烷完全燃烧生成CO2分子的数目为2.5NA
C.标准状况下,14g乙烯与2-丁烯的混合物中含有的氢原子数为2NA
D.含0.1molHNO3的稀硝酸与足量Cu反应,转移电子数为0.3NA
【答案】C
【解析】
A.CH3COO-为弱酸根离子,在水溶液中会发生水解,故1.0L0.1mol·L-1乙酸钠溶液中,CH3COO-数目小于0.1NA,A项错误;
B.标准状况下正戊烷非气态,故不能用标准状况下气体摩尔体积进行计算,B项错误;
C.设乙烯的质量为m,则根据题意,可知乙烯与2-丁烯的混合物中含有的氢原子的物质的量为![]() ,由此可知,标准状况下,14g乙烯与2-丁烯的混合物中含有的氢原子数为2NA,C项正确;
,由此可知,标准状况下,14g乙烯与2-丁烯的混合物中含有的氢原子数为2NA,C项正确;
D.稀硝酸和足量Cu发生反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,由方程式可知,每8molHNO3与Cu完全反应,转移6mole-,则含0.1molHNO3的稀硝酸与足量Cu反应,转移电子数为0.075NA,D项错误;
答案选C。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:
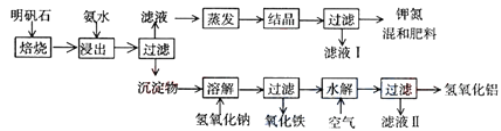
根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每升含有251.28g氨)__________mL,用规格为_______mL量筒量取。
(2)写出溶解步骤中反应得到的溶质为_________________(写化学式)
(3)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,请完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量______溶液,产生白色沉淀。
②___________、__________、_________(依次填写实验操作名称)。
③冷却、称重。
(4)若试样为mg,沉淀的物质的量为nmol,则试样中K2SO4的物质的量为:___________mol(用含有m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬酸(用H3R表示)是一种高效除垢剂。常温时,用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的物质的量百分数随pH的变化如图所示。下列说法正确的是
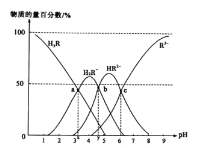
A.由a点判断H3R的第一步电离常数Ka1(H3R)的数量级为10-3
B.若b点溶液中金属阳离子只有Na+,则有c(Na+)=c(R3-)+c(HR2-)+c(H2R-)+c(H3R)
C.pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
D.反应2H2R-![]() H3R+HR2-在该温度下的平衡常数K=10x-y
H3R+HR2-在该温度下的平衡常数K=10x-y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二砷(As2O3)可用于治疗急性早幼粒白血病。利用某酸性含砷废水(含![]() 、H+、
、H+、![]() )可提取三氧化二砷,提取工艺流程如下:
)可提取三氧化二砷,提取工艺流程如下:
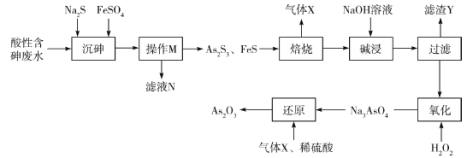
已知:①常温下,![]() ;
;![]() 。
。
②As2O3+6NaOH=2Na3AsO3+3H2O。
③As2S3易溶于过量的Na2S溶液中,故加入FeSO4的目的是除去过量的S2-。
回答下列问题:
(1)操作M的名称是________,滤液N中含有的阳离子有Fe2+、H+、________。
(2)“焙烧”操作中,As2S3参与反应的化学方程式为____________。
(3)“碱浸”的目的是_____________,“滤渣Y”的主要成分是_____________(写化学式)。
(4)“氧化”中发生反应的离子方程式为___________________。
(5)该流程中可循环使用的物质是_________(写化学式),某次“还原”过程中制得了1.98kgAs2O3,则消耗标准状况下该物质的体积是________L。
(6)溶液中金属离子的除去方法之一是Na2S沉降法。常温下,若某溶液中含Fe2+、Ag+,且浓度均为0.1mol·L-1,则向该溶液中滴加稀Na2S溶液时,先生成的沉淀是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二氧化碳和氢气为原料制取乙醇的反应为2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ΔH<0。某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示。下列说法正确的是
CH3CH2OH(g)+3H2O(g) ΔH<0。某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示。下列说法正确的是
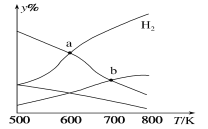
A.a点的平衡常数小于b点
B.b点,v正(CO2)=v逆(H2O)
C.a点,H2和H2O物质的量相等
D.其他条件恒定,充入更多H2,v(CO2)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正常人心脏在一次搏动中泵出血液约80 mL,正常人血压(可看作心脏压送血液的压强)平均值为1.6×104Pa,心跳每分钟约70次。设人类消耗体内的葡萄糖产生的热量最高可有80%(睡眠时)用来维持心脏的跳动,葡萄糖与氧气反应产生热量的化学方程式为:C6H12O6(s)+6O2(g)―→6CO2(g)+6H2O(g)(放出热量2804 kJ)
(1)心脏工作的平均功率约为______________;
(2)由于心脏跳动每天需消耗葡萄糖的质量是____________________________;
(3)维持生命每天需消耗氧气的体积是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是
A.乙醇和丙三醇互为同系物
B.环己烯(![]() )分子中的所有碳原子共面
)分子中的所有碳原子共面
C.分子式为C5H10O2,且属于酯的同分异构体共有9种(不考虑立体异构)
D.桥环烃二环[2,2,0](![]() )的二氯代物有6种结构(不考虑立体异构)
)的二氯代物有6种结构(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化磷酸三钠![]() 具有良好的灭菌、消毒、漂白作用。湿法磷酸由硫酸分解磷矿石得到,其中含Fe3+、Al3+等杂质。以湿法磷酸为原料制取氯化磷酸三钠的工艺流程如下:
具有良好的灭菌、消毒、漂白作用。湿法磷酸由硫酸分解磷矿石得到,其中含Fe3+、Al3+等杂质。以湿法磷酸为原料制取氯化磷酸三钠的工艺流程如下:
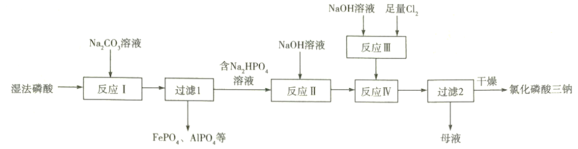
已知:a.温度高时,NaClO易分解。
b.常温下,磷酸的物种分布分数与pH的关系如下图所示:
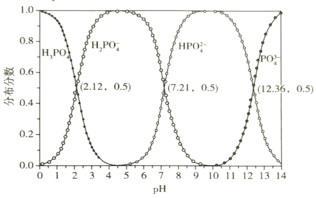
回答下列问题:
(1)硫酸分解Ca5(PO4)3F时产生的有毒气体主要是________________(填化学式)。
(2)反应Ⅰ中磷酸转化为钠盐,其钠盐再与Fe3+、Al3+作用形成沉淀。
①反应Ⅰ中发生多个反应,其中磷酸转化为Na2HPO4的主要离子方程式为___________,常温下应控制pH约为_____________________________。
②常温下,HPO![]() +Fe3+
+Fe3+![]() FePO4+H+的lgK为_________
FePO4+H+的lgK为_________![]() 。
。
(3)反应Ⅱ中不用Na2CO3溶液的原因是____________________________________________;
(4)反应Ⅲ的化学方程式为____________________________________________;
反应Ⅳ中两种溶液混合后需快速冷却,其目的是____________________________;
“母液”中的溶质有NaClO、_____________________(填2种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com