
分析 (1)元素的非金属性越强,其第一电离能越大;
(2)Ca为20号元素,有4个电子层,最外层电子数为2,失去最外层的2个电子后形成Ca2+,据此解答即可;
(3)CN22-的中心C原子为sp杂化,得到2个电子达到最外层8个电子的稳定结构,据此解答即可.
解答 解:(1)由于非金属性N>C>Ca,故第一电离能Ca<C<N,故答案为:Ca、C、N;
(2)Ca为20号元素,有4个电子层,最外层电子数为2,失去最外层的2个电子后形成Ca2+,其核外电子排布式为:1s22s22p63s23p6,故答案为:1s22s22p63s23p6;
(3)CN22-的中心C原子为sp杂化,得到2个电子后,C与N均达到最外层8个电子的稳定结构,即C与N形成三键,N与N形成单键,含有的σ键和π键的个数比为2:2=1:1,故答案为:1:1.
点评 本题主要考查的是第一电离能的大小比较、离子核外电子层排布、化学键的判断等,综合性较强,难度一般.


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:解答题
| 实验 | A | B | C | D | E | F | |
| 混 合 溶 液 | 4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 | |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 | |
| 时间(min) | 15 | 10 | 5 | 3 | 6 | 9 | |
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| , |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 钢制品应接电源的正极 | |
| B. | 电镀时铝作阳极,阳极反应式为Al-3e-+7AlCl4-=4Al2Cl7- | |
| C. | 电解液中H+移向阴极,OH-移向阳极 | |
| D. | 每生成1mol铝,电解液中转移3mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

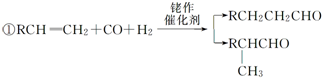
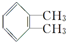 ,名称为邻二甲苯.
,名称为邻二甲苯.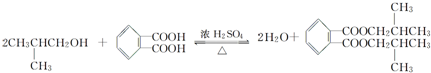 .
.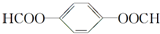 ;X分子中有2种不同化学环境的氢原子,其峰面积之比为1:2;1mol X与NaOH溶液共热反应,最多消耗4 mol NaOH.
;X分子中有2种不同化学环境的氢原子,其峰面积之比为1:2;1mol X与NaOH溶液共热反应,最多消耗4 mol NaOH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成的铜的物质的量是0.2mol | B. | 随着电解进行溶液的pH减小 | ||
| C. | 转移电子的物质的量为0.4mol | D. | 阳极反应是2H2O-4e-=4H++O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
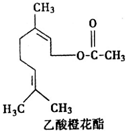
| A. | 分子式为C12H20O2 | |
| B. | 能使酸性KMnO4溶液褪色 | |
| C. | 能发生加成反应,但不能发生取代反应 | |
| D. | 1mol该有机物水解时只能消耗lmolNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

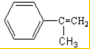
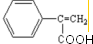
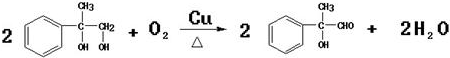 ;反应⑦n
;反应⑦n $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$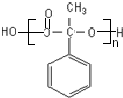 +(n-1)H2O
+(n-1)H2O查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
.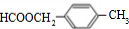 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com