
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0 kJ•mol-1(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.3 kJ•mol-1(中和热) | |
| C. | S(s)+O2(g)═SO2(g)△H=-269.8 kJ•mol-1(反应热) | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=571.6kJ•mol-1(反应热) |
分析 A.燃烧热中生成稳定氧化物,H2O(g)不稳定;
B.中和反应为放热反应;
C.燃烧为放热反应;
D.氢气燃烧为放热反应,焓变为负值.
解答 解:A.燃烧热中生成稳定氧化物,H2O(g)不稳定,1molC2H5OH(l)生成H2O(l)、CO2(g)时能量变化为燃烧热,故A错误;
B.中和反应为放热反应,应为NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,故B错误;
C.S(s)+O2(g)═SO2(g)△H=-269.8 kJ•mol-1(反应热),书写合理,故C正确;
D.氢气燃烧为放热反应,应为2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握燃烧热、中和热、反应热的关系为解答的关键,侧重分析与计算能力的考查,注意基本概念及热化学方程式书写,题目难度不大.


 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
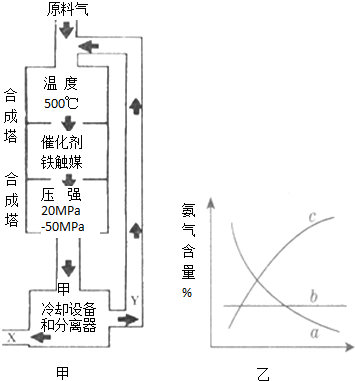 利用所学化学知识解答问题:
利用所学化学知识解答问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
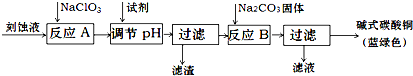
| 物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
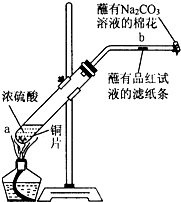 某化学实验小组为确认铜与浓硫酸反应的产物,设计如图实验装置.在一支试管中放入一块很小的铜片,再加入适量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中,塞紧试管口,在玻璃导管口处放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.回答下列问题:
某化学实验小组为确认铜与浓硫酸反应的产物,设计如图实验装置.在一支试管中放入一块很小的铜片,再加入适量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中,塞紧试管口,在玻璃导管口处放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为566.0 kJ•mol-1 | |
| B. | 反应②△H<0,所以该反应能自发进行 | |
| C. | 使用催化剂能提高其转化率 | |
| D. | 根据①和②推知总反应为2CO(g)+SO2(g)=S(s)+2CO2 (g)△H=-270kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能自发进行 | B. | 不能自发进行 | ||
| C. | 可能自发进行 | D. | 在加热条件下才能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com