
| A. | 合金一定是由两种或多种金属熔合而成的 | |
| B. | 日常生活中用到的五角硬币属于铜合金 | |
| C. | 铝合金的硬度比铝的大,熔点比铝的高 | |
| D. | 商代的司母戊鼎是由纯铜打造而成的 |
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:实验题
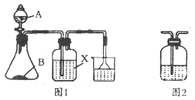 某化学兴趣小组探究二氧化硫和氯气二者的制法和性质,做下列有关实验:
某化学兴趣小组探究二氧化硫和氯气二者的制法和性质,做下列有关实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KMnO4是还原剂 | B. | HC1是氧化剂 | ||
| C. | HC1中的氯元素得到电子 | D. | KMnO4中的Mn元素被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | N2$\stackrel{O_{2}点燃}{→}$NO2$\stackrel{H_{2}O}{→}$HNO2 | |
| D. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 四种短周期元素X、Y、Z、W的部分信息如表:
四种短周期元素X、Y、Z、W的部分信息如表:| 元素 | 信息 |
| X | 原子半径最小 |
| Y | 单质在空气中含量最高 |
| Z | 其最外层电子数是电子层数的3倍 |
| W | 最高正价与最低负价的代数和为4 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 向NaAlO2溶液中逐滴滴加盐酸至过量 | 向AlCl3溶液中逐滴滴加氨水至过量 | 向明矾溶液中逐滴滴加Ba(OH)2溶液至过量 | 向澄清石灰水中缓缓通入CO2至过量 |
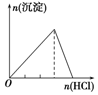 | 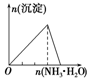 | 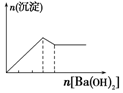 | 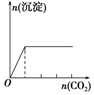 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤和水煤气均是二次能源 | |
| B. | 煤的干馏为化学变化,煤的液化和气化为物理变化 | |
| C. | 煤中含有苯、甲苯、二甲苯等有机物 | |
| D. | 由水煤气转化为甲醇或乙酸时,原子利用率均达到100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
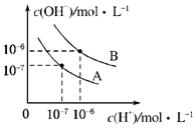 已知水在不同温度下的电离平衡曲线如图所示.(注:以下溶液混合时均不考虑体积的变化)
已知水在不同温度下的电离平衡曲线如图所示.(注:以下溶液混合时均不考虑体积的变化)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3 溶液的pH=8,则溶液中:c(CO32-)>c(H2CO3) | |
| B. | Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 10 mL pH=12 的氢氧化钠溶液中加入pH=2 的HA 溶液至pH 恰好等于7,所得溶液的总体积一定等于20 mL | |
| D. | 浓度相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中,c(NH4+)大小顺序为②>③>① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com