
| A. | A、B能形成离子化合物,且A离子半径小于B离子半径 | |
| B. | A、D能形成离子化合物DA5,与H2O反应能生成A的单质 | |
| C. | C、D的简单氢化物中只有D溶于水,其水溶液呈酸性 | |
| D. | E的两种氢化物中所有化学键种类完全相同 |
分析 B、C同周期,B的核外电子数为C的$\frac{1}{2}$,则B、C应为第二周期元素,可知A为第一周期主族元素,则A为H元素,A、B同主族,则B为Li元素,可知C的核外电子数应为6,为C元素,D的最外层电子数为C、E之和的一半,且为同周期元素,C的最外层电子数为4,则D为5、E为6,可知D为N、E为O元素,以此解答该题.
解答 解:由以上分析可知A为H元素、B为Li元素,C为C元素,D为N元素,E为O元素.
A.A、B能形成离子化合物,应生成LiH,对应离子具有相同的核外电子排布,核电荷数大的离子半径小,H-的半径大于Li+,故A错误;
B.A、D能形成离子化合物DA5,为NH4H,与水发生氧化还原反应生成氢气,故B正确;
C.氨气的水溶液呈碱性,故C错误;
D.E为O元素,对应的氢化物中水只含有极性键,过氧化氢含有极性键和非极性键,故D错误.
故选B.
点评 本题考查了原子结构和元素周期律的关系,为高考常见题型,侧重考查学生的分析能力,注意根据原子结构及元素周期表结构确定元素,把握元素周期率的递变规律,题目难度不大.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:实验题
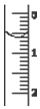 现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).
现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).| 滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ${\;}_{1}^{2}$H原子中的中子数和质子数 | |
| B. | ${\;}_{18}^{36}$Ar原子中的质量数与中子数 | |
| C. | ${\;}_{4}^{8}$Be2+中的质子数和电子数 | |
| D. | ${\;}_{12}^{26}$Mg2+中的中子数和电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3Cl2+6FeI2═4FeI3+2FeCl3 | B. | 3Cl2+2FeI2═2FeCl3+2I2 | ||
| C. | Co2O3+6HCl═2CoCl2+Cl2↑+3H2O | D. | 2Fe3++2I-═2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
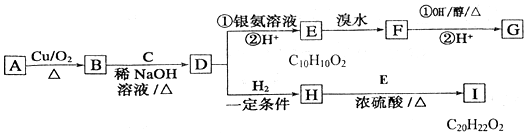
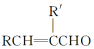 +H2O
+H2O ;E中含氧官能团的名称:羧基.
;E中含氧官能团的名称:羧基. +
+ $→_{加热}^{浓硫酸}$
$→_{加热}^{浓硫酸}$ +H2O.
+H2O.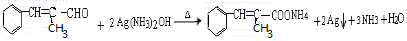 .
. .
.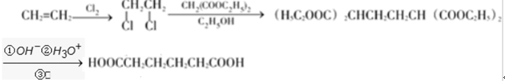 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,224 mL水中含有的电子数为0.1NA | |
| B. | 44 g由N2O和CO2组成的混合气体中含有的原子数为3NA | |
| C. | 将20 mL 0.5 mol•L-1 FeCl3溶液煮沸,所得胶粒数目为0.01NA | |
| D. | 在反应:KClO3+6HCl═KCl+3Cl2+3H2O中,每生成3mol Cl2,转移的电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在厨房里用米汤不能直接检验食盐中是否含有碘 | |
| B. | 煤炭经过干馏,可获得相对清洁的能源和重要的化工原料 | |
| C. | 利用风能、太阳能等清洁能源代替化石燃料,可减少环境污染 | |
| D. | 水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 的系统命名是2,3-二甲基-1,3-戊二烯.
的系统命名是2,3-二甲基-1,3-戊二烯.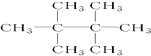 .
. .
.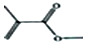 的结构简式CH2=CH(CH3)COOHCH3.
的结构简式CH2=CH(CH3)COOHCH3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com