
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(20分)
(I)多项选择题(6分)
关于化工生产的下列叙述中,正确的是 。
A.生产普通玻璃的原料是石灰石、石英、纯碱,在玻璃熔炉中发生复杂的物理化学变化
B.工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的
C.加热法只适用于软化暂时硬度的硬水
D.工业上采用电解熔融氯化铝生产金属铝
E.用高纯度焦炭与石英砂反应可制得纯度达到9个9的单晶硅材料
(II)(14分)
工业上制取硝酸铵的流程图如下,请回答下列问题:?
(1)1909年化学家哈伯在实验室首次合成了氨。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下:
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。
(2)在合成氨的设备(合成塔)中,设置热交换器的目的是 ;
在合成硝酸的吸收塔中通入空气的目的是 。
(3)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH===2NaNO2+H2O
NH3还原法:8NH3+6NO2 7N2+12H2O(NO也有类似的反应)
请从绿色化学的角度分析两种方法的优劣:
(4)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的 %。
(5)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,把应注意的事项及理由填入下表。
|
| 注意事项 | 理由 |
| ① |
|
|
| ② |
|
|
查看答案和解析>>
科目:高中化学 来源:2015届吉林省高二上学期期末考试化学试卷(解析版) 题型:填空题
化学肥料在农业生产中具有重要的作用,关系着农业生产是否丰收。化学肥料在农业生产中的广泛应用,为化学肥料的大规模工业生产提供了舞台。
(1)在合成氨的设备(合成塔)中,设置热交换器的目的是______________。
(2)生产硝酸的过程中常会产生一些氮的氧化物,一般可采用下列两种方法处理。
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
氨还原法:8NH3+6NO2 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)
请从绿色化学的角度分析两种方法的优劣:____________________。
(3)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%,NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗用NH3质量(不考虑其他损耗)的________%。
(4)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,把应注意的事项及理由填入下表(填两条应注意的事项及理由即可)。
|
|
注意事项 |
理由 |
|
① |
______________ |
____________ |
|
② |
________________ |
____________ |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省青岛市高三自评(二模)化学试卷(解析版) 题型:简答题
化学肥料在农业生产中有重要作用。农业生产中,大量施用的化肥主要是氮肥、磷肥、钾肥。
(1)普钙是磷肥,它的有效成分是__________________(写化学式)。
(2)尿素是一种含氮量较高的氮肥,工业生产尿素是将氨气与二氧化碳在加压、加热的条件下反应生成氨基甲酸铵(H2NCOONH4),再使氨基甲酸铵脱水得到尿素。反应的化学方程式为_________、___________。
(3)某化肥厂用NH3制备NH4NO3,已知由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去NH3的质量占耗用全部NH3质量的__________%。
(4)合成氨气是生产氮肥的重要环节。合成氨生产简易流程示意图如下:
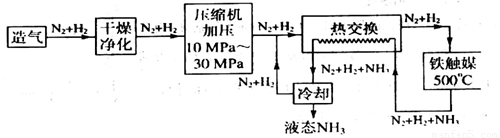
从示意图可知其存在循环操作。简要说明为什么在化工生产中经常采用循环操作___________。合成氨的反应需在500℃进行,其主要原因是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com