
| A. | 2.3 gNa+中含有NA个电子 | |
| B. | 硫酸的摩尔质量与硫酸分子的质量相等 | |
| C. | NA个CC14分子在标准状况下的体积约为22.4 L | |
| D. | 18 g H2O中含有NA个H2、NA个O |
分析 A、求出钠离子的物质的量,然后根据钠离子的核外有10个电子来分析;
B、摩尔质量的单位为g/mol;
C、四氯化碳在标况下为液体;
D、水分子是由氢原子和氧原子构成的.
解答 解:A、2.3g钠离子的物质的量为0.1mol,而钠离子的核外有10个电子,故0.1mol钠离子的核外有NA个电子,故A正确;
B、摩尔质量的单位为g/mol,而质量的单位为g,两者单位不同,且硫酸的质量数值不明确,故B错误;
C、四氯化碳在标况下为液体,故NA个四氯化碳分子即1mol四氯化碳的体积小于22.4L,故C错误;
D、水分子由氢原子和氧原子构成的,即水中不含氢气,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| W | Y | |
| X | Z |
| A. | 若W的氧化物为WO2,则Z的最高价含氧酸一定为H2ZO4 | |
| B. | 若X的单质可作半导体材料,则Y的氢化物的水溶液一定显碱性 | |
| C. | 原子半径大小顺序一定为X>Z>Y>W | |
| D. | 最高正化合价大小顺序一定为Y=Z>X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌锰干电池工作一段时间后碳棒变细 | |
| B. | 在海轮外壳上镶入锌块可减缓船体的腐蚀,是采用了牺牲阳极的阴极保护法 | |
| C. | 铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 | |
| D. | 电解MgCl2饱和溶液,可制得金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应②中反应物所具有的总能量大于生成物所具有的总能量 | |
| B. | 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1135.7 kJ/mol | |
| C. | 铂作电极,KOH溶液作电解质溶液,由反应②设计的燃料电池,当电路中转移0.16mole-,生成N211.2g | |
| D. | 铂作电极,Na2SO4作电解质溶液,由反应②设计的燃料电池,工作一段时间后恢复至原温度,Na2SO4溶液的pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2(g)+NaOH(aq)═NaHSO3(aq)△H=-(2a-b)kJ/mol | |
| B. | SO2(g)+NaOH(aq)═NaHSO3(aq)△H=-(4b-a)kJ/mol | |
| C. | SO2(g)+NaOH(aq)═NaHSO3(aq)△H=-(a-4b)kJ/mol | |
| D. | SO2(g)+NaOH(aq)═NaHSO3(aq)△H=-(4a-b)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
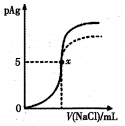 已知:pAg=-lg[c(Ag+)].Ksp(AgCl)=1×l0-10,Ksp(AgI)=l×l0-17.如图是向l0mLAgNO3溶液中加入0.lmol/LNaCI溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图象(实线).根据图象所得下列结论正确的是( )
已知:pAg=-lg[c(Ag+)].Ksp(AgCl)=1×l0-10,Ksp(AgI)=l×l0-17.如图是向l0mLAgNO3溶液中加入0.lmol/LNaCI溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图象(实线).根据图象所得下列结论正确的是( )| A. | 原AgNO3溶液的物质的量浓度为0.l mol/L | |
| B. | 图中x点表示溶液中c(Ag+)=c(Cl-) | |
| C. | 图中x点的坐标为(10,5) | |
| D. | 把NaCl溶液换成0.1 mol/L的MaCl溶液,则图象在终点后变为虚线部分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1:1:2 | B. | 2:2:2:1 | C. | 3:1:4:2 | D. | 2:1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘和干冰的升华 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 氯化钠和铁的熔化 | D. | 金刚石的熔化和冰的融化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com