
【题目】氯化亚砜(SOCl2)常用于医药、农药、染料工业,也可在有机合成工业中作氯化剂。已知:SOCl2的相关性质如下表所示:
颜色、状态 | 熔点 | 沸点 | 腐蚀性 | 水解 |
无色或微黄液体 | -105℃ | 78℃ | 强 | 极易水解 |
现利用如图装置制备SOCl2。
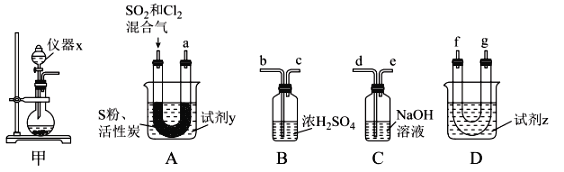
请回答下列问题:
Ⅰ.制备SO2和Cl2。
(1)本实验选用装置甲制备SO2和Cl2,装置甲中仪器x的名称为___;若以KMnO4和浓盐酸反应制备Cl2,反应的离子方程式为___。
Ⅱ.制备SOCl2。
以活性炭作为催化剂,SO2和C12可以和S粉在180~200℃时反应合成SOCl2,选用装置A、B、C、D进行制备(夹持、加热装置略去)。
(2)按气流从左到右的方向,装置A、B、C、D的连接顺序为____(填仪器接口的字母编号)。
(3)试剂y为___(填选项字母,下同);试剂z为___。
A.热水 B.乙醇 C.石蜡油 D.冰水
(4)装置A中U形管内发生反应的化学方程式为___。
(5)装置C的作用为___;若装置A处通入的SO2和Cl2的物质的量之比为1:3,则装置C中生成的盐为___(填化学式)。
【答案】分液漏斗 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O afg(gf)bcde C D SO2+2Cl2+S![]() 2SOCl2 尾气处理(或吸收未反应的SO2和Cl2) NaC1、NaClO和Na2SO4
2SOCl2 尾气处理(或吸收未反应的SO2和Cl2) NaC1、NaClO和Na2SO4
【解析】
Ⅰ.(1)根据仪器构造可得;高锰酸钾和浓盐酸反应制备Cl2,同时生成氯化锰、氯化钾和水;
Ⅱ.(2)A为制备装置,D为收集装置,B为干燥装置,连接在D后防止水蒸气进入,C为尾气处理装置;
(3)反应条件为在180~200℃,选择石蜡油维持;装置D为冷凝收集产品的装置,试剂z为冷凝,据此分析;
(4)装置A中U形管内为二氧化硫和氯气在180~200℃催化剂催化下生成SOCl2;
(5)SO2和Cl2为有毒气体,考虑尾气处理;装置A处通入的SO2和Cl2的物质的量之比为1:3,Cl2过量装置C中发生的反应为SO2+Cl2+4NaOH═2NaCl+Na2SO4+2H2O、Cl2+2NaOH═NaCl+NaClO+H2O;
Ⅰ.(1)装置甲中仪器x的名称为分液漏斗;若选用装置甲以高锰酸钾和浓盐酸反应制备Cl2,反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,
故答案为:分液漏斗 ; 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O ;
Ⅱ.(2)按气流从左到右的方向,A为制备装置,D为收集装置,B为干燥装置,连接在D后防止水蒸气进入,C为尾气处理装置,连接顺序为afg(gf)bcde,
故答案为:afg(gf)bcde;
(3)试剂y为石蜡油,能保持油浴温度为180~200℃;试剂z为冰水,冷凝收集生成的氯化亚砜,
故答案为C; D;
(4)装置A中U形管内发生反应的化学方程式为SO2+2Cl2+S![]() 2SOCl2。
2SOCl2。
(5)装置C的作用为吸收未反应的SO2和Cl2;若装置A处通入的SO2和Cl2的物质的量之比为1:3,Cl2过量,则装置C中发生的反应为SO2+Cl2+4NaOH=2NaCl+Na2SO4+2H2O、Cl2+2NaOH=NaCl+NaClO+H2O,生成的盐为NaCl、Na2SO4和NaClO;
故答案为:尾气处理(或吸收未反应的SO2和Cl2) ; NaC1、NaClO和Na2SO4


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在标准状况下,由甲烷、甲醛(HCHO)和乙烷组成的11.2升的混合气体完全燃烧后,生成0.7mol的二氧化碳气体。则混合气体中乙烷的体积分数为( )
A. 20%B. 40%C. 60%D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华文化源远流长,如![]() 本草图经
本草图经![]() 中曾有对青矾的描述:“形似朴硝
中曾有对青矾的描述:“形似朴硝![]() 而绿色,取此物置于铁板上,聚碳,封之囊袋,吹令火炽,其矾即沸,流出,色赤如融金升者是真也。”对于文中描述,下列说法正确的是
而绿色,取此物置于铁板上,聚碳,封之囊袋,吹令火炽,其矾即沸,流出,色赤如融金升者是真也。”对于文中描述,下列说法正确的是![]()
![]()
A.朴硝既不属于电解质也不属于非电解质
B.青矾的成分为![]()
C.文中使用了蒸发结晶的分离方法
D.文中的反应涉及了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒![]() 与氧同主族,硒元素及其化合物与人体健康、工业生产密切相关。某科研小组以阳极泥
与氧同主族,硒元素及其化合物与人体健康、工业生产密切相关。某科研小组以阳极泥![]() 主要成分是Se,含有CuSe,
主要成分是Se,含有CuSe,![]() 等杂质
等杂质![]() 为原料,提炼硒的流程如下:
为原料,提炼硒的流程如下:
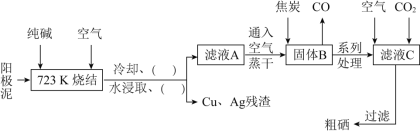
请回答下列问题:
![]() 硒原子的次外层电子数为________,与硒同周期相邻元素是________
硒原子的次外层电子数为________,与硒同周期相邻元素是________![]() 填元素名称
填元素名称![]() 。
。
![]() 已知滤液A中主要成分是
已知滤液A中主要成分是![]() ,可用于治疗克山病,则
,可用于治疗克山病,则![]() 的化学名称为________;滤液C中主要成分是
的化学名称为________;滤液C中主要成分是![]() ,则
,则![]() 的电子式为________。
的电子式为________。
![]() 上述流程图中的括号内“
上述流程图中的括号内“![]()
![]() ”,按操作先后顺序依次填写的内容是________、________。
”,按操作先后顺序依次填写的内容是________、________。
![]() 写出高温下用焦炭还原固体B的化学方程式________。
写出高温下用焦炭还原固体B的化学方程式________。
![]() 滤液C中析出硒的离子方程式为________。
滤液C中析出硒的离子方程式为________。
![]() 向
向![]() 溶液中滴加稍过量的乙酸,其离子方程式为________。已知:
溶液中滴加稍过量的乙酸,其离子方程式为________。已知:![]() 、
、![]() 、
、![]() 。
。
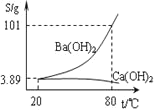
![]() 粗硒可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示:
粗硒可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示:

蒸馏操作中控制的最佳温度是________![]() 填标号
填标号![]() 。
。
A ![]() B
B ![]() C
C ![]() D
D ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的分子式为C2H4,是一种重要的化工原料和清洁能源,研究乙烯的制备和综合利用具有重要意义。请回答下列问题:
(1)乙烯的制备:工业上常利用反应C2H6(g)=C2H4(g)+H2(g)△H制备乙烯。
已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+![]() O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
Ⅲ.C2H6(g)+![]() O2(g)=2CO2(g)+3H2O(l) △H3= -1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) △H3= -1559.9kJ·mol-1。
则△H=___kJ·mol-1。
(2)乙烯可用于制备乙醇:C2H4(g)+H2O(g)=C2H5OH(g)。向某恒容密闭容器中充入amolC2H4(g)和amol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:

①该反应为___热反应(填“吸”或“放”)。
②A点时容器中气体的总物质的量为___。已知分压=总压×气体物质的量分数,用气体分压替代浓度计算的平衡常数叫压强平衡常数(KP),测得300℃时,反应达到平衡时该容器内的压强为bMPa,则A点对应温度下的KP=___MPa-1(用含b的分数表示)。
③已知:C2H4(g)+H2O(g)=C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是___(填选项字母)。
A.k正增大,k逆减小 B.k正减小,k逆增大
C.k正增大的倍数大于k逆 D.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率___10%(填“>”“<”或“=”)。
(3)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为____极(填“阴”或“阳”),对应的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钡是一种重要的无机盐产品,广泛应用于工业陶瓷、光学玻璃、建筑等行业。
![]() 生产制备:工业上一般以重晶石
生产制备:工业上一般以重晶石![]() 为原料,采用高温煅烧还原法;实验室一般以重晶石
为原料,采用高温煅烧还原法;实验室一般以重晶石![]() 为原料,采用沉淀转化法。
为原料,采用沉淀转化法。
高温煅烧还原法:
![]()
![]() 煅烧还原的化学方程式为:_____________。
煅烧还原的化学方程式为:_____________。
![]() 为了提高浸取速率,可采取的措施是__________
为了提高浸取速率,可采取的措施是__________![]() 任写一种
任写一种![]() 。
。
![]() 经检验BaS的水溶液呈碱性,原因是
经检验BaS的水溶液呈碱性,原因是![]() 用离子方程式表示
用离子方程式表示![]() __________。
__________。
沉淀转化法:向![]() 沉淀中加入饱和
沉淀中加入饱和![]() 溶液,充分搅拌,弃去上层清液。如此处理多次,直到
溶液,充分搅拌,弃去上层清液。如此处理多次,直到![]() 全部转化为
全部转化为![]() :
:![]() 平衡常数
平衡常数![]()
![]() 现有
现有![]() ,每次用
,每次用![]() 饱和
饱和![]() 溶液处理,假定
溶液处理,假定![]() 能全部转化,至少需要处理_____________次。
能全部转化,至少需要处理_____________次。
![]() 从“绿色化学”角度分析,用饱和
从“绿色化学”角度分析,用饱和![]() 溶液沉淀转化法的优点是:__________。
溶液沉淀转化法的优点是:__________。
![]() 分离提纯
分离提纯
某实验室分离提纯混有少量碳酸钙杂质的碳酸钡样品的步骤如下:
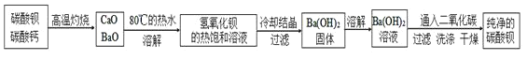
![]() 将灼烧后的固体混合物置于
将灼烧后的固体混合物置于![]() 的热水中,制成氢氧化钡的热饱和溶液。为减少
的热水中,制成氢氧化钡的热饱和溶液。为减少![]() 的损失并除去不溶物应进行的操作是_____。
的损失并除去不溶物应进行的操作是_____。
![]() 向制得的
向制得的![]() 溶液中滴加_______
溶液中滴加_______![]() 填一种试剂名称
填一种试剂名称![]() ,再通入二氧化碳。当观察到_______时,即可停止通二氧化碳。
,再通入二氧化碳。当观察到_______时,即可停止通二氧化碳。
![]() 环境监测
环境监测
![]() 环境监测某工厂废水中
环境监测某工厂废水中![]() 的浓度。取废水
的浓度。取废水![]() ,控制适当的酸度加入足量的
,控制适当的酸度加入足量的![]() 溶液,得
溶液,得![]() 沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时
沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时![]() 全部转化为
全部转化为![]() ,再加入过量KI溶液,反应液中再滴加
,再加入过量KI溶液,反应液中再滴加![]() 溶液,反应完全时,消耗
溶液,反应完全时,消耗![]() 溶液
溶液![]() 。已知有关的离子方程式为:
。已知有关的离子方程式为:![]() ;
;![]() 。
。
该工厂废水中![]() 的物质的量浓度__________
的物质的量浓度__________![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
①常温常压下,46g有机物C2H6O中含有极性键的数目一定为7NA;
②标准状况下,22.4L四氯化碳中所含有的共价键数目为4NA;
③常温下46gNO2和N2O4混合气体中含有原子数为3NA;
④常温常压下,33.6L氯气与56g铁充分反应,转移的电子数为3NA;
⑤足量铁在氯气中反应,lmol铁失去的电子数为2NA;
⑥标准状况下22.4LH2中含中子数为2NA;
⑦1LImol/L的盐酸溶液中,所含氯化氢分子数为NA。
A.①④B.②⑤⑥C.③D.②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。

请回答下列问题:
(1)甲池为______(填“原电池”“电解池”或“电镀池”),通入CH3OH 电极的电极反应式为 _____________________________________。
(2)乙池 A(石墨)电极的名称为_________(填“正极”“负极”“阴极”或“阳极”),乙池中总反应式为 ____________________________________。
(3)当乙池中 B 极质量增加 5.40 g 时,甲池中理论上消耗 O2 的体积为_____________mL(标准状况下),丙池中___________极析出 ______ g 铜。
(4)若丙中电极不变,将其溶液换成 NaCl 溶液,电键闭合一段时间后,丙中溶液的 pH 将_______(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁![]() 为白蓝色晶体,溶于强酸,不溶于水和乙醇。它是生产
为白蓝色晶体,溶于强酸,不溶于水和乙醇。它是生产![]() 的原料,实验室利用
的原料,实验室利用![]() 、
、![]() 及
及![]() 为原料制备磷酸亚铁的实验流程如图1:
为原料制备磷酸亚铁的实验流程如图1:
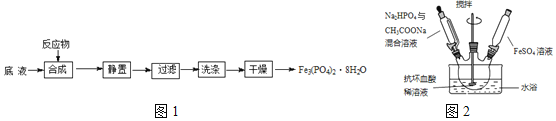
合成时的主要反应为:![]()
![]() 实验中由原料配制溶液时,蒸馏水事先要煮沸、冷却,煮沸的目的是______。
实验中由原料配制溶液时,蒸馏水事先要煮沸、冷却,煮沸的目的是______。
![]() 合成时,在三口烧瓶中先加入抗坏血酸
合成时,在三口烧瓶中先加入抗坏血酸![]() 稀溶液作底液,再向烧瓶中,滴入
稀溶液作底液,再向烧瓶中,滴入![]() 与
与![]() 混合溶液至
混合溶液至![]() 时,再滴入
时,再滴入![]() 溶液,最终维持
溶液,最终维持![]() 装置如图2所示
装置如图2所示![]() 。
。
![]() 实验不是将三种溶液直接混合的原因是______。
实验不是将三种溶液直接混合的原因是______。
![]() 用抗坏血酸溶液作底液而不用铁粉,其主要原因是______。
用抗坏血酸溶液作底液而不用铁粉,其主要原因是______。
![]() 生成的
生成的![]() 沉淀需充分洗涤,检验洗涤是否完全的方法是______
沉淀需充分洗涤,检验洗涤是否完全的方法是______
![]() 检验产品中是否混有
检验产品中是否混有![]() 或
或![]() 杂质的方法是______。
杂质的方法是______。
![]() 某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠
某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠![]() 含
含![]() 、重金属盐及有色杂质等
、重金属盐及有色杂质等![]() 提纯得到
提纯得到![]() 晶体。已知:
晶体。已知:![]() 溶液pH
溶液pH![]() ,重金属硫化物不溶于水。
,重金属硫化物不溶于水。
请补充实验步骤
![]() 实验中必须使用的试剂有:
实验中必须使用的试剂有:![]() 溶液、活性炭、
溶液、活性炭、![]() 溶液、乙醇
溶液、乙醇![]() 磷酸氢二钠在水中溶解度
磷酸氢二钠在水中溶解度![]() 水
水![]()
温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
|
|
|
|
| |||||||
|
| ||||||||||
|
|
|
|
|
| ||||||
|
|
将工业品溶于适量热水,______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com