
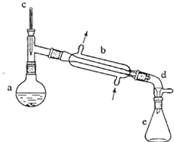
 (醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
(醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: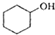 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$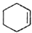 +H2O
+H2O| 相对分子质量 | 密度/(g•cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
 .
.分析 (1)根据装置图可知装置b的名称;
(2)碎瓷片的存在可以防止在加热过程中产生暴沸现象,补加碎瓷片时需要待已加热的试液冷却后再加入;
(3)加热过程中,环己醇除可发生消去反应生成环己烯外,还可以发生取代反应生成二环己醚;
(4)由于分液漏斗有活塞开关,故使用前需要检查是否漏液;分液过程中,由于环己烯的密度比水的密度小,故应该从分液漏斗的上口倒出;
(5)无水氯化钙用于吸收产物中少量的水;
(6)观察题目提供的实验装置图知蒸馏过程中不可能用到吸滤瓶和球形冷凝器管;
(7)环己醇为0.2mol,根据反应方程式,理论上可以得到0.2mol环己烯,其质量为16.4g,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)依据装置图分析可知装置b是蒸馏装置中的冷凝器装置,
故答案为:直形冷凝器;
(2)碎瓷片的存在可以防止在加热过程中产生暴沸现象,补加碎瓷片时需要待已加热的试液冷却后再加入,故选B,
故答案为:防止暴沸;B;
(3)加热过程中,环己醇除可发生消去反应生成环己烯外,还可以发生取代反应,分子间发生脱水反应生成二环己醚为 ,
,
故答案为: ;
;
(4)由于分液漏斗有活塞开关,故使用前需要检查是否漏液;分液过程中,由于环己烯的密度比水的密度小,故应该从分液漏斗的上口倒出,
故答案为:检漏;上口倒出;
(5)分离提纯过程中加入无水氯化钙的目的是利用无水氯化钙吸收产物中少量的水,
故答案为:干燥;
(6)观察题目提供的实验装置图知蒸馏过程中不可能用到吸滤瓶和球形冷凝器管,
故选CD,
故答案为:CD;
(7)环己醇为0.2mol,理论上可以得到0.2mol环己烯,其质量为16.4g,所以产率=$\frac{10g}{16.4g}$×100%=61%,
故选C,
故答案为:C.
点评 本题考查了物质制备实验方案设计,醇性质的分析应用,实验现象和原理的分析判断,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 甲苯(
甲苯(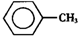 )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(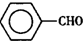 )、苯甲酸(
)、苯甲酸(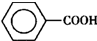 )等产品.下表列出了有关物质的部分物理性质,请回答:
)等产品.下表列出了有关物质的部分物理性质,请回答:| 称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度(ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
 ,此反应的原子利用率理论上可达66.25%.
,此反应的原子利用率理论上可达66.25%.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 0.068 MPa-1 | B. | 0.082 | C. | 0.072 MPa-1 | D. | 0.082 MPa-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 连二亚硫酸钠(Na2S2O4),又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验:
连二亚硫酸钠(Na2S2O4),又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验:| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol | |
| B. | 一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3放热akJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-2akJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=-114.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠、钾着火时,不能用泡沫灭火器灭火 | |
| B. | 氧化铝是冶炼金属铝的原料,也是较好的耐火材料 | |
| C. | 石英是制造光导纤维的原料,也是常用的半导体材料 | |
| D. | 在汽车尾气系统中装催化转化器,可降低尾气中CO、NOx等的排放量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com