
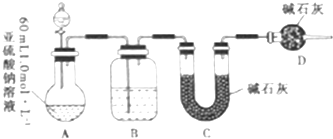
分析 装置A中的亚硫酸钠加入浓硫酸反应生成二氧化硫气体,通过装置B中浓硫酸干燥气体,用装置C吸收二氧化硫,装置D是防止空气中的水蒸气和二氧化碳干扰二氧化硫气体质量的测定,
(1)根据浓盐酸、浓硝酸和浓硫酸的性质判断应选取的物质;
(2)碱石灰能吸收二氧化硫,所以C装置增重的质量就是二氧化硫的质量,根据二氧化硫的质量计算亚硫酸钠固体中含有的亚硫酸钠,从而计算出其浓度;
(3)二氧化硫能储存在某些装置中.
解答 解:(1)A、浓硝酸有挥发性,且浓硝酸有强氧化性,能把亚硫酸根离子氧化成硫酸根离子而得不到二氧化硫气体,故A错误;
B、稀硫酸的氧化性是氢元素表现,反应速率较慢,浓硫酸主要以分子存在,而亚硫酸钠和硫酸的反应是在溶液中以离子进行反应,所以用65%硫酸和亚硫酸钠固体反应制取二氧化硫,故B正确;
C、浓盐酸有挥发性,会对实验造成干扰,故C错误,
故答案为:B;
(2)碱石灰能吸收二氧化硫,所以C装置增重的质量就是二氧化硫的质量,
设亚硫酸钠的物质的量浓度为C,
H2SO4+Na2SO3=H2O+Na2SO4+SO2↑
1mol 64g
0.06Cmol 3.2g
C=0.83mol•L-1,
故答案为:0.83;
(3)二氧化硫能储存在某些装置中导致碱石灰吸收的二氧化硫减少,造成偏差,所以存在的缺陷是:缺少一个驱赶残留二氧化硫气体的装置,
故答案为:缺少一个驱赶残留二氧化硫气体的装置.
点评 本题考查了亚硫酸钠漂白性的探究实验,难度不大,注意实验室制取二氧化硫时选取的酸不能是浓盐酸、浓硝酸和98%的浓硫酸.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题

| A. | 当n=1时,X可能是C | B. | 当n=1时,X可能是Al | ||
| C. | 当n=2时,X可能是S | D. | 当n=2时,X可能是Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀HNO3中滴加Na2SO3溶液:2H++SO32-═SO2↑+H2O | |
| B. | 向Al2(SO4)3溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| C. | 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O | |
| D. | 向0.1mol/LpH=1的KHA溶液中加入KOH溶液:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将少量某物质的溶液滴加到新制氢氧化铜中,加热 | 有红色沉淀生成 | 该物质一定属于醛类 |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| C | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体一定是SO2 |
| D | 将0.1mol/L MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol/L CuSO4溶液 | 先有白色沉淀生成后变为浅蓝色沉淀 | Cu(OH)2的溶解度小于Mg(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
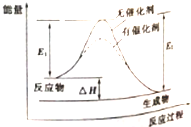
| A. | 该反应能量变化类型与CaCO3分解反应相同 | |
| B. | 加催化剂后,正反应速率加快,逆反应速率减小 | |
| C. | 若该反应为氧化还原反应,则可以将其设计成原电池 | |
| D. | 反应热△H=E2-E1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径由大到小的顺序为Z>X>Y | |
| B. | Z元素的氢化物是一种强酸 | |
| C. | 元素非金属性由强到弱的顺序为X>Y>Z | |
| D. | 3种元素的气态氢化物中,Y的气态氢化物还原性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com