


 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源:不详 题型:填空题
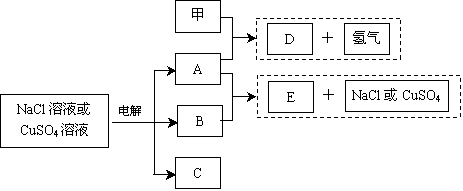

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
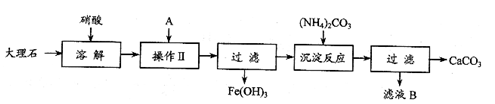

 (1)溶解大理石时,用硝酸而不用硫酸的原因是
(1)溶解大理石时,用硝酸而不用硫酸的原因是  (2)操作Ⅱ中加入的A是少量的氨水,其目的是 。
(2)操作Ⅱ中加入的A是少量的氨水,其目的是 。 (3)写出滤液B的一种用途: 。
(3)写出滤液B的一种用途: 。 (4)写出检验滤液B中是否含Fe3+的方法是
(4)写出检验滤液B中是否含Fe3+的方法是  。
。
 (5)写出加入碳酸铵所发生反应的离子方程式: 。
(5)写出加入碳酸铵所发生反应的离子方程式: 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
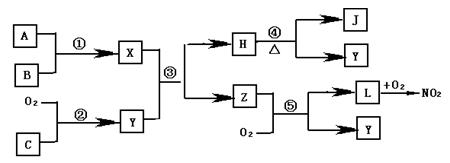
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | ② | ③ | | |
| 3 | ④ | | ⑤ | | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com