
分析 ①S、N元素的化合价降低,C元素的化合价升高,配平书写得到化学方程式:S+2KNO3+3C═K2S+N2↑+3CO2↑,结合电子守恒计算;
②实验一、取适量黑火药溶于水,过滤,将滤液蒸发浓缩,得到硝酸钾,冷却后慢慢加入浓硫酸,将混合液置于试管中并放入铜片,产生大量红棕色气体,说明铜和浓硝酸反应生成;
实验二、钾离子的检验可以采用焰色反应.
解答 解:①S元素的化合价降低0价变化为-2价,N元素的化合价降低+5价变化为0价,C元素的化合价升高0价变化为+4价,单质转移总数12e-,结合单质守恒配平书写化学方程式为:S+2KNO3+3C═K2S+N2↑+3CO2↑,反应中当有1molCO2生成时,转移的电子数为4NA,
故答案为:4NA;
②实验一:取适量黑火药溶于水,过滤,将滤液蒸发浓缩,得到硝酸钾,冷却后慢慢加入浓硫酸,将混合液置于试管中并放入铜片,产生大量红棕色气体,说明铜和浓硝酸反应生成,反应的离子方程式为:Cu+4H++2NO3- Cu2++2NO2↑+2H2O;
实验二:钾离子的检验可以采用焰色反应,方法是:用铂丝蘸取待测液,分放在火焰上灼烧,通过蓝色的钴玻璃观察火焰的颜色,若呈现紫色,证明含有钾离子,反之则没有,
故答案为:Cu+4H++2NO3- $\frac{\underline{\;\;△\;\;}}{\;}$Cu2++2NO2↑+2H2O;用铂丝蘸取待测液,分放在火焰上灼烧,通过蓝色的钴玻璃观察火焰的颜色,若呈现紫色,证明含有钾离子,反之则没有.
点评 本题考查氧化还原反应方程式的配平以及物质的性质和方程式的书写知识,题目难度中等,侧重分析与计算能力的考查,注意掌握氧化还原反应方程式的配平方法.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | c(Na+)═c(HCO3-)+c(CO32-)+c(H2CO3) | B. | c(Na+)+c(H+)═c(HCO3-)+2c(CO32-)+c(OH-) | ||
| C. | HCO3-的电离程度小于其水解程度 | D. | c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
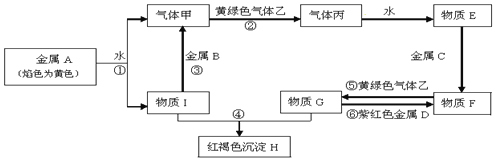
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c=4 g+10 h | B. | c-b=2 d+3 f | C. | 2 d+3 f=3 g+8 h | D. | a+c=d+f |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液和Cu的反应:Cu+Fe3+═Cu2++Fe2+ | |
| B. | 醋酸溶液水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | NO2与氢氧化钠的反应:3NO2+2OH-═NO3-+NO2-+2H2O | |
| D. | 向NaAlO2溶液中通入过量SO2:2AlO2-+SO2+3H2O═2A(OH)3↓+SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg(OH)2不能转化为Ca(OH)2 | B. | Ca(OH)2的溶解度最小 | ||
| C. | Ca(OH)2不能转化为 Mg(OH)2 | D. | Ksp越大,S不一定越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
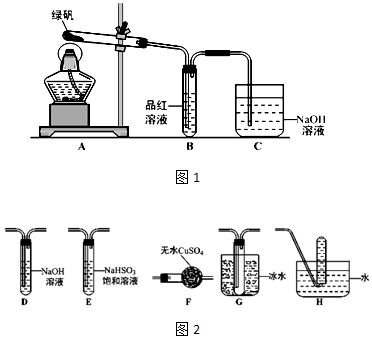
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com