
CO2��CH4��������Ҫ���������壬ͨ��CH4��CO2��Ӧ�������ֵ��ѧƷ��Ŀǰ���о�Ŀ�ꡣ
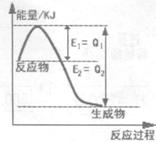
��1��250��ʱ�������Ͻ�Ϊ��������4 L������ͨ��6 mol CO2��6 mol CH4���������·�Ӧ��CO2 (g)��CH4(g) 2CO(g)��2H2(g)��ƽ����ϵ�и��������������±���
2CO(g)��2H2(g)��ƽ����ϵ�и��������������±���
���� | CH4 | CO2 | CO | H2 |
������� | 0.1 | 0.1 | 0.4 | 0.4 |
�ٴ��¶��¸÷�Ӧ��ƽ�ⳣ��K=__________
����֪��CH4(g)��2O2(g)��CO2(g)��2H2O(g) ��H=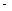 890.3 kJ��mol��1
890.3 kJ��mol��1
CO(g)��H2O (g)��CO2(g)��H2 (g) ��H=+2.8 kJ��mol��1
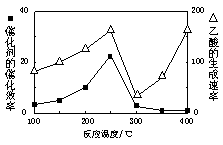
2CO(g)��O2(g)��2CO2(g) ��H=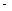 566.0 kJ��mol��1
566.0 kJ��mol��1
��ӦCO2(g)��CH4(g) 2CO(g)��2H2(g) �ġ�H=________________[��Դ��ȫ,Ʒ����&��*��+��]
2CO(g)��2H2(g) �ġ�H=________________[��Դ��ȫ,Ʒ����&��*��+��]
��2���Զ������ѱ��渲��Cu2Al2O4Ϊ���������Խ�CO2��CH4ֱ��ת�������ᡣ
���ڲ�ͬ�¶��´����Ĵ�Ч���������������������ͼ��ʾ��250��300��ʱ���¶����߶�������������ʽ��͵�ԭ����_____________________
��Ϊ����߸÷�Ӧ��CH4��ת���ʣ����Բ�ȡ�Ĵ�ʩ��________________________
�۽�Cu2Al2O4�ܽ���ϡ�����е����ӷ���ʽΪ___________________________
��3��Li2O��Na2O��MgO��������CO2�������Ѱ������CO2���������ʣ����н����������______
a.���ڼ�����������Ѱ��
b.���ڢ�A����A��Ԫ���γɵ���������Ѱ��
c.���ھ���ǿ�����Ե�������Ѱ��
��Li2O����CO2�������ںϳ�Li4SiO4��Li4SiO4�������ա��ͷ�CO2��ԭ���ǣ���500�棬CO2��Li4SiO4�Ӵ�������Li2CO3��ƽ��������700�棬��Ӧ������У��ų�CO2��Li4SiO4������˵����ԭ���Ļ�ѧ����ʽ��___________________________
��4�����÷�ӦA�ɽ��ͷŵ�CO2ת��Ϊ���й�ҵ���ü�ֵ�IJ�Ʒ��
��ӦA��
���µ�⼼���ܸ�Чʵ�֣�3���з�ӦA������ԭ��ʾ��ͼ���£�

CO2�ڵ缫a�ŵ�ķ�Ӧʽ��_____________________________________________
��֪ʶ�㡿��Ӧ�ȵļ��㡢��ѧƽ�ⳣ���ĺ��塢��ѧƽ���Ӱ�����ء����ԭ��
���𰸽������Ţ�64 ��+247.3 kJ·mol��1
�Ƣ��¶ȳ���250��ʱ�������Ĵ�Ч�ʽ���
������Ӧѹǿ������CO2��Ũ��
��3Cu2Al2O4+32H++2NO3��=6Cu2++ 6Al3++2NO��+16 H2O
��3����ab ��1�֣� ��CO2 + Li4SiO4  Li2CO3 + Li2SiO3
Li2CO3 + Li2SiO3
��4��CO2 + 2e- == CO+O2-
��������1���� CO2��g��+CH4��g��⇌2CO��g��+2H2��g��
��ʼ��mol�� 6 6 0 0
��Ӧ��mol�� X X 2X 2X
ƽ�⣨mol�� 6-X 6-X 2X 2X
��CH4���������Ϊ0.1����(6-x)/(12+2x)=0.1�����X=4������K=(22��22)/(0.5��0.5)=64
��CH4��g��+2O2��g��=CO2��g��+2H2O��g����H=-890.3kJ•mol-1 ��
CO��g��+H2O ��g��=CO2��g��+H2 ��g����H=2.8kJ•mol-1 ��
2CO��g��+O2��g��=2CO2��g����H=-566.0kJ•mol-1 ��
���ݸ�˹���ɣ��ɢ�+�ڡ�2-�ۡ�2��
CO2��g��+CH4��g��⇌2CO��g��+2H2��g����H=(-890.3+2.8��2+566.0��2) kJ•mol-1=+247.3 kJ•mol-1��
��2�����¶ȳ���250��ʱ�������Ĵ�Ч�ʽ��ͣ������¶����߶�������������ʽ��ͣ�
������Ӧѹǿ������CO2��Ũ�ȣ�ƽ�������ƶ�����Ӧ��ת��������
��Cu2Al2O4������������ʽ��Cu2O•Al2O3�����ᷴӦ�������ӷ���ʽ��
3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO��+16H2O��
��3����a��Li2O��Na2O��MgO�����ڼ��������������������������CO2�����ڼ�����������Ѱ������CO2���������ʣ���a��ȷ��
b��Li2O��Na2O��MgO��������CO2���ơ�þ����Ϊ��A����A��Ԫ�أ����Կ��ڢ�A����A��Ԫ���γɵ���������Ѱ������CO2���������ʣ���b��ȷ��
c��Li2O��Na2O��MgO��������CO2�������Ƕ�û��ǿ�����ԣ������ն�����̼��������ԭ�أ���c���� �ʴ�Ϊ��ab��
����500�棬CO2��Li4SiO4�Ӵ�������Li2CO3����Ӧ��ΪCO2��Li4SiO4����������Li2CO3�����������غ��֪���ﻹ��Li2SiO3�����Ի�ѧ����ʽΪCO2 + Li4SiO4  Li2CO3 + Li2SiO3��
Li2CO3 + Li2SiO3��
��4��������̼��a���õ����ӷ�����ԭ��Ӧ����һ����̼ͬʱ���������ӣ���Ӧ�缫��ӦʽΪ��CO2+2e-═CO+O2-��
��˼·�㲦��������Ҫ�������ۺ�����CO2���漰�Ȼ�ѧ��Ӧ���绯ѧ����ѧƽ��Ӱ�����صȣ���Ϊ�ۺϣ���Ŀ�Ѷ��е�


 �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���з�Ӧ��Ӧ�����ӷ���ʽ��д��ȷ���� (����)��
A��Ư��¶���ڿ�����ʧЧ��ClO����CO2��H2O=HClO��HCO
B������������Һ������������Һ��Ӧ����Һǡ��Ϊ���ԣ�
Ba2����H����SO ��OH��=BaSO4����H2O
��OH��=BaSO4����H2O
C��Na2O2��H2O��Ӧ�Ʊ�O2��Na2O2��H2O=2Na����2OH����O2��
D����ǿ������Һ�д���������Fe(OH)3��Ӧ����Na2FeO4��
4OH����3ClO����2Fe(OH)3=2FeO ��3Cl����5H2O
��3Cl����5H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����̼���仯�����ת����˵���У���ȷ����(����)
A��������CO2�����ľ���������Ȼ����̼���仯������ƽ��û��Ӱ��
B��ľ̿ȼ�չ����У�����̼���ʡ�CO��CO2֮���ת��
C��̼�����������ת��������������ԭ��Ӧ
D����̼������������л�������֮��������ϸ�Ľ��ޣ��������ﲻ�ܺϳ��л�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
д�����и����ķ���ʽ��
(1)����B�ķ����к���200����ԭ��________��
(2)1 L����D��������ȫȼ��ʱ������ͬ��ͬѹ��15 L��ˮ����________��
(3)��֪�ڱ�״���£�ij��̬�����ܶ�Ϊ1.34 g��L��1����0.1 mol����̬�л�����ȼ������8.8 g CO2��5.4 g H2O________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���û�ѧ��Ӧԭ���о�Ԫ�ؼ��仯����ķ�Ӧ����Ҫ���塣
��1�����������У�SO2����������SO3��2SO2(g)�� O2(g) 2SO3(g)�������ϵ��SO3�İٷֺ������¶ȵĹ�ϵ����ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������ͼʾ�ش��������⣺
2SO3(g)�������ϵ��SO3�İٷֺ������¶ȵĹ�ϵ����ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������ͼʾ�ش��������⣺
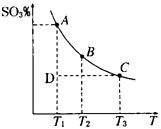
��2SO2(g) + O2(g) 2SO3(g)�ġ�H____0(�>������<��)�����ں��¡���ѹ������������ƽ����ϵ��ͨ�뺤����ƽ�� �ƶ�����������ҡ����ƶ����� ��
2SO3(g)�ġ�H____0(�>������<��)�����ں��¡���ѹ������������ƽ����ϵ��ͨ�뺤����ƽ�� �ƶ�����������ҡ����ƶ����� ��
�����¶�ΪT1ʱ����Ӧ���е�״̬Dʱ��V��_______V�����>����<����=����
��2�����ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ����������Ҫ���á�
�� ��ͼ��һ�����¶Ⱥ�ѹǿ��N2��H2��Ӧ����lmolNH3�����������仯ʾ��ͼ����д����ҵ�ϳɰ����Ȼ�ѧ����ʽ������H�ú���ĸQ1��Q2�Ĵ���ʽ��ʾ�� ��
����AlCl3��Һ�еμӰ�ˮ����Ӧ�����ӷ���ʽΪ�� ��
��3����ˮ�к��д�����Ԫ�أ�����Ԫ�����ȡ���Ԫ������ں�ˮ�о��Ի���̬���ڡ���25���£���0.1mol•L��1��NaCl��Һ����μ���������0.1mol•L��1��������Һ���а�ɫ�������ɣ���Ӧ�����Һ�У���������0.1mol•L��1��NaI��Һ�������������� ȫƷ��ѧ���� �ú��벻�ˣ��������������ԭ���ǣ������ӷ���ʽ��ʾ���� ��
ȫƷ��ѧ���� �ú��벻�ˣ�����֪25��ʱKsp[AgCl] =1.0��10-10 mol2•L��2��Ksp[AgI] =1.5��10-16mol2•L��2 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
п�̸ɵ�������������ʹ�������϶̣���Ϊһ���Ե�أ�����֮���������ӵ����ⲻ���˷��˱���Ľ�����Դ�����һ���������صĻ�����Ⱦ���±��Ǹ����ص��ۺϳɷַ��������
| Ԫ�� | п[��Դ��ȫ,Ʒ����&��*��+��] | �� | �� | ͭ | ̼ | ���� |
| �����ٷֺ��� | 13��27 | 14��28 | 23��26 | 0.5��0.7 | 5��6 | 13 |
ͨ���Ļ�е������������и���ֽ���������ȵķ��룬�Ӷ�ʹ�����������̵õ����ٷֱ��пƤ���̷ۣ�MnO2������ʪ��������ͨ��Ԥ��������ȡ�������ȹ����Ƴ���Ʒ��������������ͼ��
��������֪�����ӳ�����ȫ��pHΪ
| ���� | Fe3+ | Fe2+ | Cu2+ | Mn2+ |
| pH | 3.2 | 9.0 | 6.7 | 10.1 |
��֪��пԪ������Ԫ�����ƣ��������ԡ�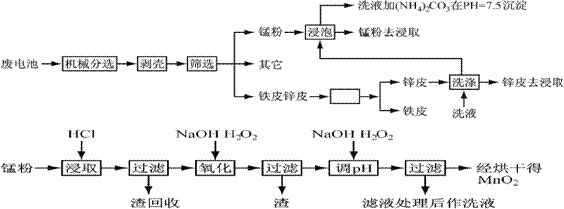
1������п�̸ɵ��Ϊ���Ե�أ��������ҺΪKOH,����������ӦΪ ��
�缫�ܷ�Ӧ����Ϊ ��
2����Ԥ�����У�������Ƥ��пƤ�ķ����� ��ϴҺ��(NH4)2CO3��pH��7.5������һ�ּ�ʽ�Σ������ʵĻ�ѧʽΪ ��
3���������������У�д������30%�����ܽ�ʱ�����ӷ���ʽ �������ܽ����յ����� ��
4����֪�ڶ��μ�H2O2�����pH��9��Ŀ��Ϊ��Mn2+ת��ΪMnO2,���һ�μ�H2O2�����pH��5��Ŀ���� ��
5��ʵ�������ø��������Һ����Mn2+ʱ��������ɫ�������÷�Ӧ�����ӷ���ʽΪ
��
6���������ڸ��������¿��Եõ�������������ȷֽ�ķ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���������Ҫ�ɷֿɱ�ʾΪFeO·Cr2O3��������MgO��Al2O3��Fe2O3�����ʣ��������Ը�����Ϊԭ���Ʊ��ظ���أ�K2Cr2O7��������ͼ��
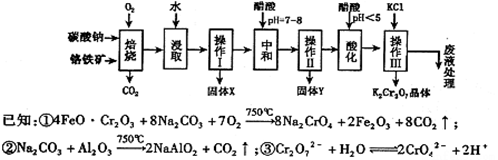
��������ش��������⣺
��1��������������� ������X����Ҫ���� ����д��ѧʽ����
��2���ô��������ҺpH=7��8���ٽ��в��������ù���Y�ijɷ�Ϊ ��д��ѧʽ��.
��3���ữ�����е�����ҺpH��5ʱ������Ӧ2CrO42����2H+��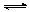 Cr2O72����H2O.����������������ᣬ�������Cr2O72����Ӧ��ɴ�����Ⱦ������Cr3+���ʣ��÷�Ӧ�����ӷ���ʽΪ .
Cr2O72����H2O.����������������ᣬ�������Cr2O72����Ӧ��ɴ�����Ⱦ������Cr3+���ʣ��÷�Ӧ�����ӷ���ʽΪ .
��4���±���������ʵ��ܽ�����ݣ�����III������Ӧ�Ļ�ѧ����ʽ��
Na2Cr2O7+2KCl=K2Cr2O7��+2NaCl���÷�Ӧ����Һ���ܷ����������ǣ� ��
��5��������������ˮ���������ŷŶ��������滷���м����Σ������ⷨ�Ǵ�������Ⱦ��һ�ַ�������������������ʯī��������⺬Cr2O72-�����Է�ˮ��һ��ʱ������Fe(OH)3��Cr(OH)3������
 �ٵ�ⷨ������ˮ���ܷ�Ӧ���£���ƽ����д��ȱ��(��֪������n(Fe(OH)3): n (H2)=1:1)
�ٵ�ⷨ������ˮ���ܷ�Ӧ���£���ƽ����д��ȱ��(��֪������n(Fe(OH)3): n (H2)=1:1)
___Fe��___Cr2O72-��___ ��___H2O ��___Fe(OH)3����___Cr(OH)3����___H2����
����֪������Cr(OH)3��Ksp=6.4��10–32mol4/l4����������������ˮˮ�ʱ������������ֵ��0.052 mg/L��Ҫʹ��Һ��c(Cr3+)������������ˮˮ�ʱ����������Һ��pH����______��
����֪lg2=0.3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ˮ����ˮ���жԻ���ѡ�ɵ���ȾԽ��Խ���ء�ijУ����С���ͬѧ��Ϊ�����ý�������ˮ�е�NO3����ԭ��N2���Ӷ�������Ⱦ��
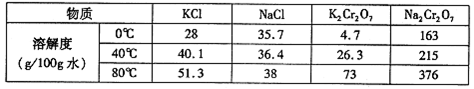
(1) ��ƽ�����йص����ӷ�Ӧ����ʽ��
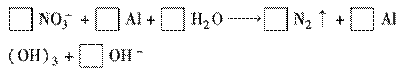
(2)���Ϸ�Ӧ��ʧ���ӵ�������________����ԭ������________��ÿ����1 mol���ֻ�ԭ�������________���ӷ���ת�ơ�
(3)�����ȥ1  m3����0.3 mol�ķ�ˮ�е�NO3��(�赪Ԫ�ض���NO3������ʽ����)����������Ҫ���Ľ�����________��
m3����0.3 mol�ķ�ˮ�е�NO3��(�赪Ԫ�ض���NO3������ʽ����)����������Ҫ���Ľ�����________��
(4)�������������Ⱦ�ķ����к����ۣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����£���0.2mol/LAl2(SO4)3��Һ�У���μ���1.0mol/LNaOH��Һ��ʵ������ҺpH��NaOH��Һ����仯��������ͼ�������й�˵����ȷ����
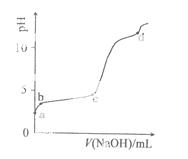
A��a��ʱ����Һ�����Ե�ԭ����Al3+ˮ�⣬���ӷ���ʽΪ��
Al3++3OH- Al
Al (OH)3
(OH)3
B��a��b�Σ���ҺpH����Al3+Ũ�Ȳ���
C��b��c�Σ������OH-��Ҫ��������Al(OH)3����
D��d��ʱ��Al(OH)3������ʼ�ܽ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com