

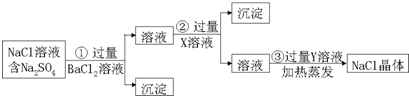
分析 根据图1可知,制备硫化钠晶体的流程为:无水芒硝(Na2SO4)与碳在高温煅烧反应:3Na2SO4+8C$\frac{\underline{\;高温\;}}{\;}$3Na2S+4CO2↑+4CO↑,由于硫离子水解,则用稀碱溶液浸泡抑制硫离子水解,通过精制获得硫化钠晶体,
(1)煅烧中得到等物质的量的CO和CO2,S元素被还原得到Na2S;
(2)热水促进硫化钠水解,用碱液抑制硫化钠水解;
(3)过滤操作时,玻璃棒的作用为引流;
(4)硫化钠实际用量与理论用量比值x越小、汞除去率越高,最佳效果;
(5)据Ksp(HgS)=1.6×10-52,c(S2-)=1×10-5mol/L计算可求得c(Hg2+),进而确定HgS的溶解度;
(6)①H2S通入Na2SO4溶液中,生成Na2SO3和S,根据元素守恒书写离子方程式;
②根据碘与淀粉显蓝色,选择指示剂,根据Na2S2O3的物质的量,结合2S2O32-+I2═S4O62-+2I-,计算碘的物质的量,碘水中I2的含量.
解答 解:(1)煅烧中得到等物质的量的CO和CO2,S元素被还原得到Na2S,反应方程式为:3Na2SO4+8C$\frac{\underline{\;\;△\;\;}}{\;}$3Na2S+4CO2↑+4CO↑;
故答案为:3Na2SO4+8C$\frac{\underline{\;\;△\;\;}}{\;}$3Na2S+4CO2↑+4CO↑;
(2)Na2S是强碱弱酸盐,水解后溶液显碱性,加热会促进S2-水解,而加碱则可以抑制其水解,
故答案为:热水能促进Na2S水解,而稀碱可抑制Na2S水解;
(3)进行过滤操作时,玻璃棒的作用为引流;
故答案为:玻璃棒的作用为引流;
(4)硫化钠实际用量与理论用量比值x越小、汞除去率越高,最佳效果,由图象可知当pH介于9~10时,x=12时汞的除去率最大,
故答案为:12;9~10之间;
(5)据Ksp(HgS)=1.6×10-52,c(S2-)=0.1mol/L计算可求得c(Hg2+)=1.6×10-51mol/L,所以HgS溶解度为1.6×10-51×(32+201)×$\frac{100}{1000}$g=3.728×10-50g,
故答案为:3.728×10-50g;
(6)①H2S通入Na2SO4溶液中,生成Na2SO3和S,反应的离子方程式为2H2S+SO42-+4H+═3S↓+4H2O,
故答案为:2H2S+SO42-+4H+═3S↓+4H2O;
②根据碘与淀粉显蓝色,所以选择淀粉作指示剂,根据题意,Na2S2O3的物质的量为0.01000mol•L-1×10.00mL=1.0×10-4 mol,结合2S2O32-+I2═S4O62-+2I-,可知碘的物质的量为5.0×10-5 mol,所以碘水中I2的含量为$\frac{5.0×10{\;}^{-5}mol×254g/mol}{0.025L}$=5.08×10-4 g•mL-1,
故答案为:淀粉;5.08×10-4.
点评 本题考查了物质制备、电解原理及其应用等知识,题目难度中等,试题涉及物质制备原理、化学方程式书写方法、电解原理及电极反应式的书写、溶度积常数的计算等,试题侧重考查学生的分析、理解能力及灵活应用所学知识的能力,是一道质量较好的题目.


科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸滴在大理石上:CaCO3+2H+=Ca2++H2CO3 | |
| B. | 硫酸与氢氧化钡反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 氧化铜与稀硫酸反应:2H++O2-═H2O | |
| D. | 碳酸钠溶液中加入盐酸:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
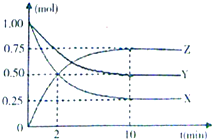 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O
+H2O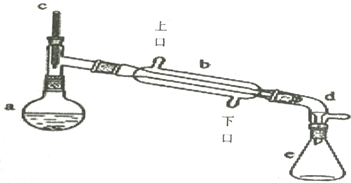
| 相对分子质量 | 密度/(g.cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b | B. | a<b<2a | C. | 2a=b | D. | 2a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
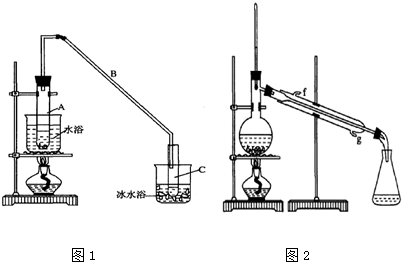

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
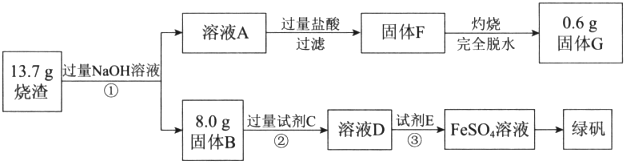
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
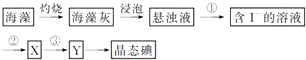

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com