
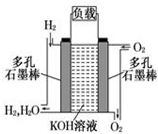
 如图为氢氧燃料碱性电池,电极材料为疏松多孔石墨棒.根据所学知识试回
如图为氢氧燃料碱性电池,电极材料为疏松多孔石墨棒.根据所学知识试回分析 (1)燃料电池中电子从负极流向正极,正极上氧气得电子和水生成氢氧根离子;
(2)根据电极方程式中电子与氧气的关系求算;
(3)原电池中阳离子移向正极,根据总反应判断溶液酸碱性的变化;
(4)甲烷燃料电池中甲烷在负极失电子生成碳酸根离子和水,先写出负极反应式,然后写出相应的电极反应式.
解答 解:(1)氢氧燃料电池中,电解质溶液为碱,则正极上氧气得电子和水生成氢氧根离子,则其电极反应式为:2H2O+O2+4e-═4OH-;
故答案为:2H2O+O2+4e-═4OH-;
(2)已知2H2O+O2+4e-═4OH-,则每转移0.1mol电子消耗的氧气为:$\frac{1}{4}$×0.1mol=0.025mol,所以V(O2)=nVm=0.025mol×22.4L/mol=0.56L;
故答案为:0.56;
(3)原电池中阳离子移向正极;燃料电池的总反应为2H2+O2=2H2O,反应后溶液体积增大,溶液的碱性减弱;
故答案为:正极;减弱;
(4)燃料电池中,负极上燃料失电子发生氧化反应,碱性条件下,甲烷在负极生成碳酸根离子,其电极反应式为:CH4+10OH--8e-═CO32-+7H2O;正极上氧气得电子和水生成氢氧根离子;正负极上的电极反应式相加得总反应方程式,所以总反应方程式为CH4+2O2+2OH-═CO32-+3H2O.故答案为:CH4+10OH--8e-═CO32-+7H2O;CH4+2O2+2OH-═CO32-+3H2O.
点评 本题考查了燃料电池电极反应式及电池反应方程式的书写,燃料在负极上失电子发生氧化反应,氧化剂在正极上得电子发生还原反应,书写电极反应式时要结合电解质溶液确定生成的离子.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子键没有方向性和饱和性,而共价键有方向性和饱和性 | |
| B. | 金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用 | |
| C. | 配位键在形成时,是由成键双方各提供一个电子形成共用电子 | |
| D. | 三种不同的非金属元素可以形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅤⅡA | O |
| 2 | b | h | c | |||||
| 3 | d | i | g | j | e | a | ||
| 4 | f |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ,该化合物所含化学键为共价键;
,该化合物所含化学键为共价键;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 将饱和FeCl3溶液滴入沸水中 | 溶液变红褐色 | 有Fe(OH)3生成 |
| B | 向Na2S溶液中滴加盐酸 | 产生气泡 | Cl的非金属性比S强 |
| C | 向溶液中滴加盐酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中含有SO42- |
| D | 用导线连接铜片和锌片后插进盐酸中 | 铜片上有气泡 | 铜片是原电池的正极 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com