
| A.原子半径X>Y>Z | B.气态氢化物的稳定性HX>H2Y>ZH3 |
| C.非金属性X>Y>Z | D.阴离子的还原性Z3->Y2->X- |
科目:高中化学 来源:不详 题型:实验题
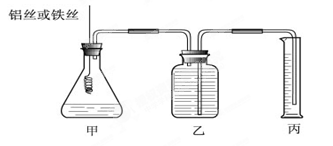

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.X的气态氢化物比Y的稳定 | B.X与Y形成的化合物都易溶于水 |
| C.Z的非金属性比Y的弱 | D.原子半径:X>Y>Z>W |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.①④ | C.②④ | D.②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X、M两种元素形成的化合物的晶体中一定含有离子键,不可能含有共价键 |
| B.由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低 |
| C.元素Y、Z、W的单质晶体的熔点高低顺序为:Y>Z>W |
| D.化合物ZW2的分子空间构型为直线形 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.镁原子由基态转化成激发态,这一过程中吸收能量 |
| B.镁原子由激发态转化成基态,这一过程中释放能量 |
| C.转化后位于p能级上的两个电子处于同一轨道,且自旋状态相同 |
| D.转化后镁原子与硅原子电子层结构相同,化学性质相似 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
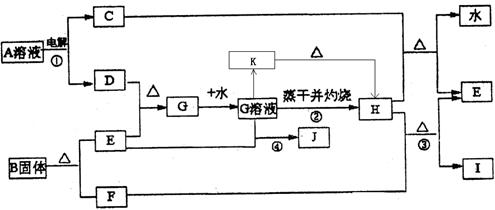
 则样品中G的质量分数为: 。
则样品中G的质量分数为: 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com