
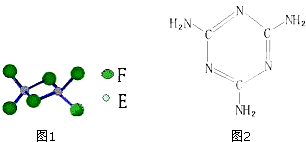
分析 A、C能形成两种化合物甲和乙,原子个数比分别为2:1和1:1,甲为常见的溶剂,这说明甲是水,则A是H元素,C是O元素,乙是H2O2;B、C相邻且同周期,且B的原子序数小于氧元素的,则B是N元素;E是地壳中含量最多的金属元素,属于E是Al;A、D同主族,且D的原子序数小于铝的,所以D是Na元素;F元素为同周期电负性最大的元素,且F的原子序数大于铝元素的,所以F是Cl元素;D和F可形成化合物丙,则丙是NaCl;E和F可形成化合物丁,则丁是AlCl3;G为第四周期未成对电子数最多的元素,因此G是Cr元素,再结合题目分析解答.
解答 解:A、C能形成两种化合物甲和乙,原子个数比分别为2:1和1:1,甲为常见的溶剂,这说明甲是水,则A是H元素,C是O元素,乙是H2O2;B、C相邻且同周期,且B的原子序数小于氧元素的,则B是N元素;E是地壳中含量最多的金属元素,属于E是Al;A、D同主族,且D的原子序数小于铝的,所以D是Na元素;F元素为同周期电负性最大的元素,且F的原子序数大于铝元素的,所以F是Cl元素;D和F可形成化合物丙,则丙是NaCl;E和F可形成化合物丁,则丁是AlCl3;G为第四周期未成对电子数最多的元素,因此G是Cr元素,
(1)G是Cr元素,其3d、4s能级分别有5、1个电子,根据构造原理可知,G基态原子的外围电子排布式是3d54s1,故答案为:3d54s1;
(2)由于O原子核外价电子排布式2s22p4,而N原子核外价电子排布式2s22p3,2p亚层属于半充满的稳定结构,难失去一个电子,因此第一电离能较大的是氮元素,
故答案为:N;O原子核外价电子排布式2s22p4,而N原子核外价电子排布式2s22p3,2p亚层属于半充满的稳定结构,难失去一个电子,因此第一电离能较大;
(3)甲是水、乙是双氧水,在双氧水中2个氧原子之间存在非极性键,故答案为:H2O2;
(4)①由于NaCl是离子晶体,Al2Cl6是分子晶体,离子晶体熔点比分子晶体高,所以丙和丁比较,熔点较低的化合物是Al2Cl6,
故答案为:Al2Cl6;NaCl是离子晶体,Al2Cl6是分子晶体,离子晶体熔点比分子晶体高;
②氯化铝是共价化合物,含有极性键,形成的晶体是分子晶体,存在范德华力,又因为分子还含有配位键,故选BDE;
(5)生成的0.287g白色沉淀是氯化银,物质的量是0.287g÷143.5g=0.002mol,这说明该化合物能电离出2个氯离子,则根据配位数是6以及Cr元素的化合价为+3价可知,化学式是〔CrCl(H2O)5〕Cl2,
故答案为:〔CrCl(H2O)5〕Cl2;
(6)根据三聚氰胺的结构简式可知,环上的氮原子既含有单键,也含有双键,所以是sp2杂化,而氨基中的氮原子全部形成单键,属于sp3杂化,
故答案为:sp2、sp3.
点评 本题考查位置结构性质相互关系及运用,为高频考点,涉及配合物、原子杂化、元素周期律、原子核外电子排布等知识点,明确原子结构、元素周期表结构、位置结构等知识点是解本题关键,熟练掌握配合物结构及其性质、价层电子对互斥理论、构造原理等知识点,注意基础知识点的掌握和灵活运用,题目难度不大.


科目:高中化学 来源: 题型:解答题
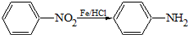 (苯胺,易被氧化).甲苯是一种重要的有机化工原料,可用来合成多种重要的有机物.以甲苯为初始原料合成阿司匹林等有机物的转化关系图(部分产物、合成路线、反应条件略去)如下.
(苯胺,易被氧化).甲苯是一种重要的有机化工原料,可用来合成多种重要的有机物.以甲苯为初始原料合成阿司匹林等有机物的转化关系图(部分产物、合成路线、反应条件略去)如下.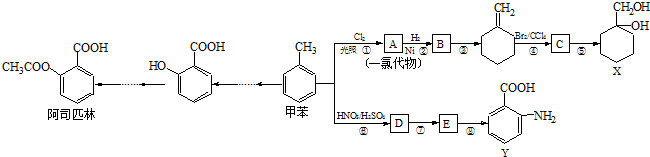
 ,C
,C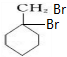 ,E
,E .
.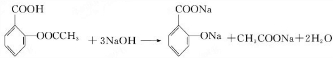 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、AlO2-、CrO42-、CO32- | B. | Na+、AlO2-、CO32- | ||
| C. | Na+、AlO2-、CO32-、SO42- | D. | Na+、Ba2+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | D>B>A>C | C. | D>A>C>B | D. | C>A>B>D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
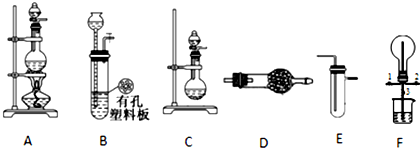
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) | |
| B. | CH3COOH溶液加醋酸钠溶液,因醋酸根水解显碱性,电离平衡向正反应方向移动 | |
| C. | CH3COOH溶液中加入少量的CH3COONa固体,平衡逆向移动 | |
| D. | 常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷是含碳量最低的碳氢化合物 | |
| B. | 所有的碳氢化合物分子组成均符合Cn H2n+2的通式 | |
| C. | 碳氢化合物一般都不溶于水 | |
| D. | 碳氢化合物分子中的化学键一定有极性键,也可能有非极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com