
| A. | 常温下,强酸溶液的pH=a将溶液的体积稀释到原来10n倍,则pH=a+n | |
| B. | 已知 BaSO4的Ksp=c(Ba2+)•c(SO${\;}_{4}^{2-}$),所以在 BaSO4,溶液中有 c(Ba2+)=c(SO${\;}_{4}^{2-}$)=$\sqrt{{K}_{sp}}$ | |
| C. | 向硝酸押溶液中滴加稀盐酸得到的pH=4的混合溶液:c(k+)<c(NO${\;}_{3}^{-}$) | |
| D. | 将0.1mol•L-1的MaHS和0.1molL-1Na2S溶液等体积混合,所得溶液中有c(S2-)+2c(0H-)=2c(H+)+c(HS-)+3c(H2S) |
分析 A.若a+n<7时,常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n;但是若a+n≥7时,溶液稀释后其pH不可能大于7,只能无限接近7;
B.对于饱和溶液,在BaSO4溶液中有c(Ba2+)=c(SO42-)=$\sqrt{K{s}_{p}}$,若溶液不饱和,该关系不成立;
C.硝酸钾溶液中c(k+)=c(NO3-);
D.根据0.1mol•L-1的NaHS和0.1mol•L-1 Na2S混合溶液中物料守恒和电荷守恒进行判断.
解答 解:A.常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,若a+n<7时,则pH=a+n;但是若a+n≥7时,溶液稀释后其pH不可能大于7,溶液的pH只能无限接近7,故A错误;
B.已知BaSO4的Ksp=c(Ba2+)•c(SO42-),对于饱和溶液BaSO4溶液中,则有c(Ba2+)=c(SO42-)=$\sqrt{K{s}_{p}}$,但是若溶液不是饱和溶液,该关系不会成立,故B错误;
C.硝酸钾溶液中钾离子和硝酸根离子均不水解,而且加盐酸也不发生反应,所以溶液中c(k+)=c(NO3-),故C错误;
D.将0.1mol•L-1的NaHS和0.1mol•L-1 Na2S溶液等体积混合,根据物料守恒可得:2c(Na+)=3[c(HS-)+c(H2S)+c(S2-)],根据电荷守恒可知:c(H+)+c(Na+)=2c(S2-)+c(OH-)+c(HS-),由电荷守恒和物料守恒联立可得:c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S),故D正确.
故选D.
点评 本题考查了溶液pH的计算、溶液中离子浓度大小比较、难溶电解质的沉淀平衡等知识,题目难度中等,注意掌握酸碱混合后溶液的定性判断及溶液中pH的计算方法,学会利用电荷守恒、物料守恒、盐的水解原理比较溶液中离子浓度大小.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
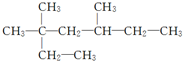 的命名正确的是( )
的命名正确的是( )| A. | 2,4-二甲基-2-乙基己烷 | B. | 3,5,5-三甲基庚烷 | ||
| C. | 3,3-二甲基-5-甲基庚烷 | D. | 3,3,5-三甲基庚烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如下图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如下图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提高溶液的温度 | B. | 加入适量的醋酸钠固体 | ||
| C. | 加入等体积0.2mol•L-1盐酸 | D. | 将溶液稀释到原体积的10倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:| 步骤① | 往5mL1mol/LFeCl3溶液中通入SO2气体,溶液立即变为红棕色,微热在较短时间内溶液颜色变为浅绿色. |
| 步骤② | 往5mL重新配制的1mol/LFeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色,短时间内溶液颜色变为浅绿色. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一列的元素都是金属元素 | |
| B. | 第三列所含的元素种类最多 | |
| C. | 第18列元素原子的最外层电子数均为8 | |
| D. | 只有第二列元素的最外层电子数为2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下铝遇浓硫酸钝化,因此可用铝槽车储运浓硫酸 | |
| B. | 硫在空气中燃烧生成大量SO3 | |
| C. | 浓硫酸可以干燥H2、NH3、CO2等气体 | |
| D. | SO2的漂白原理与次氯酸相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4:1 | B. | 2:1 | C. | 1:4 | D. | 1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com