
| A. | 1mol FeCl3完全转化为Fe(OH)3胶体后形成NA个胶粒 | |
| B. | 1 L 0.1 mol/L Na2CO3溶液中CO32-和HCO3-总数为0.1 NA | |
| C. | 标准状况下,22.4L NO和11.2L O2混合后气体的分子总数为NA | |
| D. | 0.2 mol乙炔和乙醛混合气体在氧气中完全燃烧,消耗氧气的分子数为0.5NA |
分析 A、FeCl3水解是可逆反应,1mol FeCl3完全转化为Fe(OH)3胶体后形成胶粒小于NA;
B、溶液中存在物料守恒,碳原子守恒;
C、A、由2NO+O2═2NO2,2NO2?N2O4,利用气体的物质的量来分析分子总数;
D、先分析乙炔和乙醛的分子式,乙醛燃烧需要氧气的量与相同物质的量的乙炔燃烧需要氧气的量相同,所以乙炔和乙醛都可以认为是乙炔,然后根据乙炔燃烧的方程式计算需要氧气的物质的量.
解答 解:A、FeCl3水解是可逆反应,1mol FeCl3完全转化为Fe(OH)3胶体后形成胶粒小于NA,故A错误;
B、1 L 0.1 mol/L Na2CO3溶液中H2CO3、CO32-和HCO3-总数为0.1 NA,故B错误;
C、A、标准状况下,22.4LNO和11.2L氧气的物质的量分别为1mol、0.5mol,由2NO+O2═2NO2,2NO2?N2O4,则气体的分子总数小于NA个,故C错误;
D、乙炔的分子式是C2H2,乙醛的分子式是C2H4O,乙醛的分子式可认为C2H2.H2O,乙炔和乙醛燃烧时需要氧气的量,可以认为都是乙炔燃烧需要的氧气量,
2 C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$2H2O+4CO2,
2mol 5NA
0.4mol NA
所以0.4 mol乙炔和乙醛混合气体,在氧气中充分燃烧,消耗氧气的分子数为NA,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,注意电解质溶液中物料守恒分析,气体摩尔体积的条件应用,胶体组成,一氧化氮和氧气反应生成的二氧化氮可以聚合为四氧化二氮,题目难度中等.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:填空题
| 周期 | IA | ⅡA | ⅢA | IVA | VA | VIA | VⅡA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
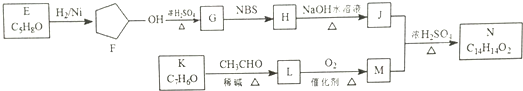
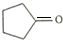 .
. .
.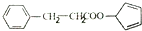 ,请再写出三种五元环上不是含一个双键的同分异构体:
,请再写出三种五元环上不是含一个双键的同分异构体: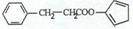 、
、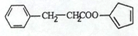 、
、 .
.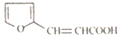 )是一种医治血吸虫病的药呋喃丙胺的原料.请以
)是一种医治血吸虫病的药呋喃丙胺的原料.请以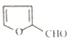 、CH3CH2OH为有机原料合成呋喃.(无机试剂及溶剂任选)
、CH3CH2OH为有机原料合成呋喃.(无机试剂及溶剂任选)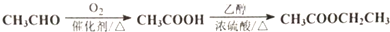
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | (1) | (2) | 分类标准 |
| A | 盐酸、漂白粉、水玻璃、双氧水 | 氨水 | 混合物 |
| B | CH3COOH,H2CO3、HClO、NH3•H2O | HF | 弱电解质 |
| C | 电解反应、盐的水解、煤的干馏、石油裂化 | 钢铁生锈 | 化学变化 |
| D | CO2、SO3、P2O5、SiO2 | Al2O3 | 酸性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
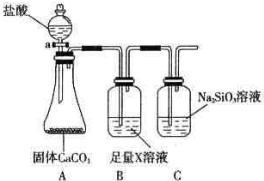
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol硫酸钾中阴离子所带电荷数为NA | |
| B. | 标准状况下,分子数为NA的CO、N2混合气体体积约为22.4 L,质量为28 g | |
| C. | 铝跟氢氧化钠溶液反应,生成3.36 L H2,转移的电子数为0.3 NA | |
| D. | 50 mL 8 mol/L的浓盐酸与足量的MnO2加热反应,生成Cl2的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
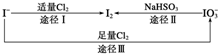 碘是人体所必需的因素之一回答以下有关碘的问题:
碘是人体所必需的因素之一回答以下有关碘的问题:| KI起始浓度/mol•L-1 | 0.02 | 0.04 | 0.06 | 0.08 | 0.10 |
| I3-% | 88.98 | 88.04 | 85.28 | 82.26 | 79.23 |
| I42-% | 4.38 | 8.67 | 12.60 | 16.21 | 19.53 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和反应属放热反应 | |
| B. | 化学变化中的能量变化主要由化学键变化引起的 | |
| C. | 煤、石油、天然气是当今世界最重要的三种化石燃料 | |
| D. | 相同条件下,1mol石墨转化为金刚石要吸收1.895kJ热量,说明金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,氯化铵水解程度增大 | |
| B. | 水解平衡向右移动,溶液的pH一定减小 | |
| C. | 向溶液中加入氯化钠固体,能抑制氯化铵的电离 | |
| D. | 向溶液中加入氯化铵固体,水解平衡向右移动,水解程度增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com