
| A. | HCO3-+H2O?H3O++CO32- | B. | HS-+H2O?H2S+OH- | ||
| C. | H2PO4-+H2O?HPO42-+H3O+ | D. | HCO3-+OH-?H2O+CO32- |
分析 水解反应的实质是:弱酸或弱碱离子结合水电离出的氢离子或氢氧根离子生成弱电解质的过程,水解反应方程式用可逆符号表示,以此分析得出正确结论.
解答 解:A、HCO3-+H2O?H3O++CO32-,是碳酸氢根离子的电离方程式,不是水解离子方程式,故A错误;
B、HS-+H2O?H2S+OH-,是硫氢根离子的水解离子方程式,故B正确;
C、H2PO4-+H2O?HPO42-+H3O+,是磷酸二氢根离子的电离方程式,故C错误;
D、HCO3-+OH-?H2O+CO32-,是碳酸氢根离子和氢氧根离子发生的复分解反应,故D错误;
故选B.
点评 本题考查学生对水解反应原理的理解,题目难度不大,明确水解的反应原理是解答本题的关键,注意区分反应、水解和电离.


科目:高中化学 来源: 题型:选择题
| A. | 米酒密封储存变香的过程涉及取代反应 | |
| B. | 甲烷、氯乙烯和硝基苯都属于烃类 | |
| C. | 有机化合物均易燃烧 | |
| D. | 糖类、脂肪和蛋白质在一定条件下都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
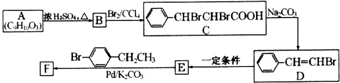
 (写结构简式).
(写结构简式).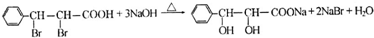
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1×10-2 mol•L-1 | B. | 1×10-8 mol•L-1 | C. | 1×10-12 mol•L-1 | D. | 1×10-4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
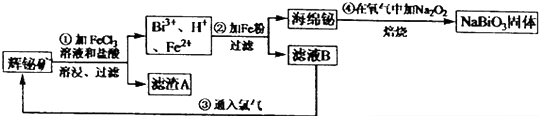
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑦ | B. | ②⑤⑥⑧ | C. | ①③④⑦ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 2.22 | C. | 3.46 | D. | 4.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
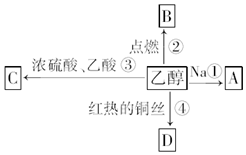 乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是有机物.
乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是有机物.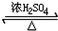 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:填空题
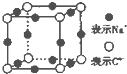 A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A~F为短周期主族元素,G为第四周期元素.已知:A是原子半径最小的元素,B和D同周期,固态的BD2能升华,E、F在B、D的下一周期,且E原子的最外层电子数与次外层电子数之比为3:4;G的质子数比F多12.请回答:
A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A~F为短周期主族元素,G为第四周期元素.已知:A是原子半径最小的元素,B和D同周期,固态的BD2能升华,E、F在B、D的下一周期,且E原子的最外层电子数与次外层电子数之比为3:4;G的质子数比F多12.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com