
| A. | pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-) | B. | pH>7,且c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | ||
| C. | pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | D. | pH=7,且c(CH3COO-)>c(Na+)>c(H+)=c(OH-) |
分析 A.氢离子和氢氧根离子反应生成水,钠离子不参加反应;
B.任何电解质溶液都存在电荷守恒;
C.常温下,pH<7,说明溶液呈酸性;
D.常温下,pH=7,说明溶液呈中性,根据电荷守恒来回答.
解答 解:A、氢离子和氢氧根离子反应生成水,钠离子不反应,所以c(Na+)>c(OH-),故A选;
B.任何电解质溶液都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故B不选;
C.常温下,pH<7,说明溶液呈酸性,则c(OH-)<c(H+),根据电荷守恒:c(CH3COO-)>c(Na+),c(CH3COO-)>c(H+)>c(Na+)>c(OH-)可以是剩余大量醋酸时候的情况,故C不选;
D.常温下,pH=7,说明溶液呈中性,则c(OH-)=c(H+),根据电荷守恒:c(CH3COO-)=c(Na+),故D选.
故选AD.
点评 本题考查了物质的推断、离子浓度大小的比较,明确溶液中存在的溶质及其性质是解本题关键,并结合溶液的酸碱性、电荷守恒来分析解答,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Na投入足量盐酸中:2Na+2H2O=2Na++2OH-+H2↑ | |
| B. | Cl2通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| C. | 向Na2CO3溶液中加入少量盐酸:CO32-+2H+=H2O+CO2↑ | |
| D. | NaHCO3溶液中加入过量澄清石灰水:Ca2++HCO3-+OH-=H2O+CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
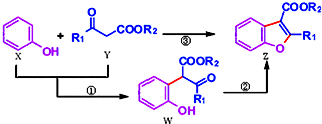 科学家用催化剂将苯酚(X)和1,3-二羰基化合物(Y)合成一种重要的具有生物活性的结构单元--苯并呋喃(Z),W是中间产物(R1、R2均为烃基).则下列有关叙述不正确的是( )
科学家用催化剂将苯酚(X)和1,3-二羰基化合物(Y)合成一种重要的具有生物活性的结构单元--苯并呋喃(Z),W是中间产物(R1、R2均为烃基).则下列有关叙述不正确的是( )| A. | 反应①属于取代反应 | B. | W中至少含有1个手性碳原子 | ||
| C. | X、Y、W、Z都能与NaOH溶液反应 | D. | 可用溴水或FeCl3溶液鉴别X和W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解得到的汽油是纯净物 | |
| B. | 石油产品都可用于聚合反应 | |
| C. | 水煤气是通过煤的液化得到的气态燃料 | |
| D. | 天然气是清洁燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为CH2CH2 | B. | 6个中子的碳原子的符号:12C | ||
| C. | Cl-的结构示意图: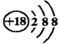 | D. | NaCl的电子式: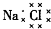 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给烧杯里的液体直接加热 | |
| B. | 将配制的NaOH溶液保存在配有玻璃塞的细口瓶中 | |
| C. | 用蒸发方法使KCl 从溶液中析出时,应将蒸发皿中KCl 溶液全部加热蒸干 | |
| D. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
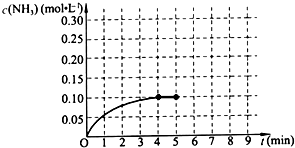 已知工业上合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0.在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
已知工业上合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0.在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相关信息 | |
| X | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得X的单质, 该单质常温下化学性质很稳定. |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
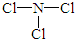
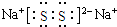 ,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2
,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大自然利用太阳能最成功的是植物的光合作用 | |
| B. | H2是理想的清洁燃料,储存和运输方便,在现实生活和生产中已大量应用 | |
| C. | 海水淡化技术的进步有助于淡水资源紧缺问题的解决 | |
| D. | 利用工业废气中的CO2制造全降解塑料,符合绿色环保要求 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com