
| A. | 同一主族的元素从上到下金属性逐渐减弱 | |
| B. | 元素周期表是元素周期律的具体表现形式 | |
| C. | 同一周期从左到右,元素原子半径逐渐增大 | |
| D. | 非金属元素的最高正化合价等于它的负化合价的绝对值 |
分析 A.同一主族的元素从上到下金属性逐渐增强;
B.元素周期律是核外电子周期性变化的必然结果;
C.同一周期从左到右,元素原子半径逐渐减小;
D.一般来说,非金属元素的最高正化合价和它的负化合价的绝对值之和等于8.
解答 解:A.同一主族的元素从上到下,原子半径逐渐增大,原子核对最外层电子的吸引力减弱,则金属性逐渐增强,故A错误;
B.元素周期律是核外电子周期性变化的必然结果,则元素周期表是元素周期律的具体表现形式,故B正确;
C.同一周期从左到右,随着原子序数的递增,原子半径逐渐减小,故C错误;
D.一般来讲非金属元素的最高正化合价与其负化合价的绝对值之和为8,如S元素的最高正化合价为6,而它的负化合价的绝对值为2,故D错误;
故选B
点评 本题考查原子结构与元素周期律的应用,为高考常见题型,侧重于学生的分析能力的考查,熟悉元素周期表结构及原子结构是解本题关键,结合元素周期律来分析解答,注意把握元素的性质与元素周期表的关系,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
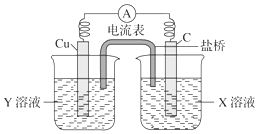 (1)利用反应Cu+2FeCl3═CuCl2+2FeCl2设计成如图所示的原电池,回答下列问题:
(1)利用反应Cu+2FeCl3═CuCl2+2FeCl2设计成如图所示的原电池,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
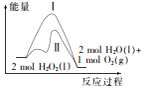
| A. | 该反应的△H<0,△S>0 | |
| B. | 途径Ⅱ与途径I相比,可能是加了催化剂 | |
| C. | 其他条件相同时,产生相同体积的氧气时放出的热量:途径I>途径Ⅱ | |
| D. | 其他条件相同时,产生相同体积的氧气所需的时间:途径I>途径Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ①②③④⑤ | C. | ①②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硫酸比次氯酸稳定 | B. | 硫酸的酸性弱于高氯酸 | ||
| C. | H2S比HCl被氧化 | D. | 气态HC1比气态H2S稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素和非金属分界线附近的元素 | |
| B. | 左、下方区域的金属元素 | |
| C. | 右、上方区域的非金属元素 | |
| D. | 稀有气体元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.
一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com