
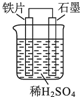
| A. | 石墨电极作负极 | |
| B. | 铁片上的反应:Fe-2e-=Fe2+ | |
| C. | 铁电极附近溶液中氢离子浓度增大 | |
| D. | 电子由石墨电极通过导线流向铁电极 |
分析 在用铁、石墨和硫酸组成的原电池装置中,铁的活泼性大于石墨的活泼性,所以铁片作负极,负极上铁失电子发生氧化反应,石墨作正极,正极上氢离子得电子发生还原反应,电子从负极沿导线流向正极,以此解答.
解答 解:A、在用铁、石墨和硫酸组成的原电池装置中,铁的活泼性大于石墨的活泼性,所以铁片作负极,石墨作正极,故A错误;
B、铁片作负极,负极上铁失电子发生氧化反应,即Fe-2e-=Fe2+,故B正确;
C、石墨作正极,氢离子移向正极石墨上得电子发生还原反应,故C错误;
D、电子从负极沿导线流向正极,即从铁流向石墨,故D错误.
故选B.
点评 本题考查原电池知识,为高考高频考点,侧重于学生的分析能力和基本概念的理解和运用的考查,注意把握原电池的组成以及工作原理,学习中注意相关基础知识的积累,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
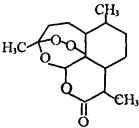 2015年我国科学家屠呦呦因发现青蒿素-一种用于治疗疟疾的药物,对人类的生命健康贡献突出而获得2015年诺贝尔生理学或医学奖.青蒿素结构如图所示.已知一个碳原子上连有4个不同的原子或基团,该碳原子称“手性碳原子”.下列有关青蒿素的说法不正确的是( )
2015年我国科学家屠呦呦因发现青蒿素-一种用于治疗疟疾的药物,对人类的生命健康贡献突出而获得2015年诺贝尔生理学或医学奖.青蒿素结构如图所示.已知一个碳原子上连有4个不同的原子或基团,该碳原子称“手性碳原子”.下列有关青蒿素的说法不正确的是( )| A. | 青蒿素能与碳酸氢钠溶液反应生成二氧化碳 | |
| B. | 青蒿素分子有7个手性碳原子 | |
| C. | 青蒿素在一定条件下能与NaOH溶液反应 | |
| D. | 青蒿素是脂溶性的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯分子有1个δ键,1个π键 | |
| B. | 乙烯分子中2个碳原子都是sp3杂化 | |
| C. | 乙烯分子存在非极性键 | |
| D. | 乙烯分子中所有原子都在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀硝酸中加入铁粉 | |
| B. | 向稀盐酸中滴入少量的NaAlO2溶液 | |
| C. | 向NaOH溶液中通入CO2气体 | |
| D. | 向MgSO4、H2SO4的混合溶液中加入过量的Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,碳氢键之间键角为109°28′.甲烷和氯气在光照下发生取代反应,生成5种产物.产物中CCl4常用作灭火剂.试写出三溴甲烷在光照条件下与溴蒸气反应的化学方程式:CHBr3+Br2$\stackrel{光照}{→}$CBr4+HBr.
,碳氢键之间键角为109°28′.甲烷和氯气在光照下发生取代反应,生成5种产物.产物中CCl4常用作灭火剂.试写出三溴甲烷在光照条件下与溴蒸气反应的化学方程式:CHBr3+Br2$\stackrel{光照}{→}$CBr4+HBr.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
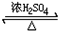 HCOOCH3+H2O
HCOOCH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量少 | |
| B. | 由单质A转化为单质B时△H=+119 kJ•mol-1可知单质B比单质A稳定 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ | |
| D. | 在101 kPa时,H2燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2在101 kPa时的燃烧热为571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用苯萃取碘水中的碘时,将碘的苯溶液从分液漏斗下口放出 | |
| B. | Na2SiO3溶液中通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失 | |
| C. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| D. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com