
| A. | 乙酸乙酯、油脂、糖类、蛋白质都可以发生水解反应 | |
| B. | 乙烯和聚丙烯都能与氢气在一定条件下发生加成反应 | |
| C. | 油脂在碱性条件下可发生水解,工业上利用该反应生产肥皂 | |
| D. | 乙烯、苯、乙醇均能使紫色的酸性高锰酸钾溶液褪色 |
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:选择题
| A. | PbO2是电池的负极 | |
| B. | 正极反应式为:Pb+SO42--2e-═PbSO4 | |
| C. | H2SO4起传导电子的作用 | |
| D. | 电池放电时,溶液pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤气的主要成分是甲烷 | |
| B. | 若0.2mol某烃在O2中充分燃烧时,生成水和CO2各1.2mol,则该烃为苯 | |
| C. | 乙烯能使溴水和酸性高锰酸钾溶液褪色,其褪色原理不同 | |
| D. | 煤的干馏属于化学变化,而煤的液化和气化属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的总能量大于生成物的总能量的反应一定是吸热反应 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| C. | 铜与稀硝酸反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 氨气的还原性可以解释氨气与氯化氢的反应实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2+H2O=HCl+HClO | B. | 2H2O+2F2=4HF+O2 | ||
| C. | ICl+H2O=HCl+HIO | D. | 2Na+2H2O=2NaOH+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强碱性溶液中:K+,Mg2+,SO42- | |
| B. | pH=1的硝酸溶液中:Fe3+,Na+,Cl- | |
| C. | pH=1的盐酸溶液中:AlO2-,Na+,SO42- | |
| D. | 某无色溶液中:Al3+,K+,OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 性质叙述正确的是( )
性质叙述正确的是( )| A. | 1 mol该有机物可以与3 mol Na发生反应 | |
| B. | 1 mol该有机物可以与3 mol NaOH发生反应 | |
| C. | 1 mol该有机物可以与6 mol H2发生加成反应 | |
| D. | 1 mol该有机物分别与足量Na或NaHCO3反应,产生的气体在相同条件下体积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
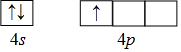
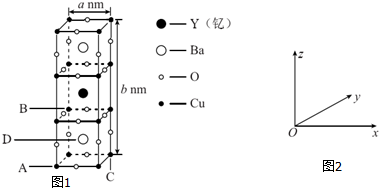
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com