
| A. | 加水的体积为vL | |
| B. | 加水的质量为mg | |
| C. | 0.5amol/L的氨水质量分数等于0.5b% | |
| D. | 0.5amol/L的氨水质量分数小于0.5b% |
分析 根据稀释定律计算稀释后溶液的体积,结合m=ρV、溶液密度判断稀释后溶液的质量,进而确定水的质量,根据c=$\frac{1000ρω}{M}$、结合溶液密度判断质量分数.
解答 解:a mol/L的氨水溶液的密度为dg/mL,0.5a mol/L的氨水溶液的密度为D g/mol,则d<D,
根据稀释定律,稀释后溶液的体积为$\frac{vL×amol/L}{0.5amol/L}$=2v,则稀释后溶液质量大于2mg,故加入水的质量大于mg,稀释后溶液的体积不等于浓氨水的体积与水的体积之和,则加入水的体积不是V L,
设0.5a mol/L氨水的质量分数为w,根据c=$\frac{1000ρω}{M}$可知,a=$\frac{1000d×b%}{17}$,0.5a=$\frac{1000D×w}{17}$,结合d<D,联立可得0.5a<0.5b%,
综上分析可知,ABC错误,D正确,
故选D.
点评 本题考查溶液浓度计算,涉及物质的量浓度、质量分数计算,注意理解掌握物质的量浓度与质量分数之间的关系,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 随原子序数递增,ⅦA族元素的最高价氧化物对应水化物酸性逐渐增强 | |
| B. | 第三周期元素中(除稀有气体元素)简单离子半径最小的元素,其氧化物具有两性 | |
| C. | 第三周期气态氢化物的沸点均为同主族中沸点最低的,是因为其分子内含有氢键 | |
| D. | 第二周期元素(除稀有气体元素)的最高化合价数值逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
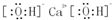 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白色沉淀是BaSO3 | B. | 白色沉淀是BaSO3和BaSO4的混合物 | ||
| C. | 白色沉淀是BaSO4 | D. | FeCl3已全部被氧化为FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向25mL沸水中滴加5-6滴稀的FeCl3溶液制备氢氧化铁胶体 | |
| B. | 只用少量水就可鉴别Na2CO3和NaHCO3固体 | |
| C. | 用FeSO4、NaOH和盐酸等试剂在空气中可以制备较纯净的FeCl3溶液 | |
| D. | 用NaOH溶液和盐酸可除去MgCl2溶液中混有的AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
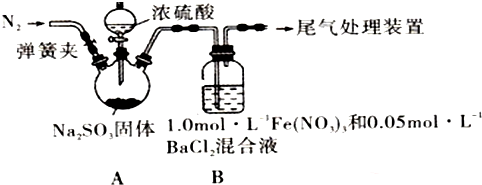
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ①用NaNO3和盐酸配成pH=1, C(NO3-)=3mol•L-1的溶液,并替换装置B中的Fe(NO3)3溶液. ②打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹.再打开分液漏斗活塞,向三颈烧瓶中滴加浓硫酸. | 若装置B中有白色沉淀生成,猜想2成立.否则,猜想2不成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
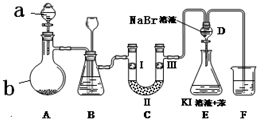 实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).
实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 无水氯化钙 | 浓硫酸 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸发皿加热蒸发溶液时,盛液体的量不能超过其容积的$\frac{1}{3}$ | |
| B. | 用托盘天平可称10.50g K2SO4晶体 | |
| C. | 用10mL量筒量取8.50mL稀H2SO4溶液 | |
| D. | 加热坩埚不需要垫石棉网 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨能在空气中燃烧,生成N2和水 | |
| B. | NO2溶于水生成HNO3,NO2属于酸性氧化物 | |
| C. | 所有的铵盐加热分解都能产生NH3 | |
| D. | 铜与浓硝酸反应时,硝酸既表现氧化性又表现酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com