
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是 ;所含阴离子相同的两种盐的化学式是 。
(2)D的化学式为 ,D溶液显碱性的原因是(用离子方程式表示) 。
(3)E和氨水反应的离子方程式是 。
(4)设计实验检验B中所含的阳离子:
(1)Cu2+、Fe3+ (NH4)2SO4、Al2(SO4)3
(2)Na2CO3 CO32-+H2O? ?HCO3-+OH-
?HCO3-+OH-
(3)Al3++3NH3·H2O==Al(OH)3↓+3NH4+
(4)取少量B于试管中,滴加少量NaOH溶液,在试管口附近放一张湿润的红色石蕊试纸,加热,若试纸变蓝,说明B中阳离子为NH4+
解析试题分析:由①五种盐均溶于水,水溶液均为无色,得出溶液中无Fe3+ 、Cu2+ ,
由②D的焰色反应呈黄色,说明阳离子中一定有Na+ ;
由③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性,说明A是钠盐或钡盐,B、C、E的溶液可能含NH4+ 或Al3+ ,D的溶液是碳酸盐,且只能是Na2CO3;
由④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀,说明A、C的溶液中可能含有Cl―、NO3―;
由⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失,说明E为Al3+ 、结合④C不含Cl―, C为AgNO3;
由⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀,说明A是BaCl2,由⑤得E为Al2(SO4)2,结合③B为(NH4)2SO4,
综上所述:A是BaCl2,B为(NH4)2SO4, C为AgNO3,D是Na2CO3,E为Al2(SO4)2
⑴五种盐中,一定没有的阳离子是溶液呈蓝色的Cu2+、溶液呈黄色的Fe3+ ;所含阴离子相同的两种盐的化学式是(NH4)2SO4、Al2(SO4)3;答案:Cu2+、Fe3+ ;(NH4)2SO4、Al2(SO4)3
⑵D的化学式为Na2CO3,是强碱弱酸盐,在水溶液中发生水解,呈碱性: CO32-+H2O HCO3-+OH-,答案:Na2CO3 CO32-+H2O
HCO3-+OH-,答案:Na2CO3 CO32-+H2O HCO3-+OH-
HCO3-+OH-
⑶E为Al2(SO4)3和氨水反应的离子方程式是Al3++3NH3·H2O==Al(OH)3↓+3NH4+,答案:Al3++3NH3·H2O==Al(OH)3↓+3NH4+
⑷B中所含的阳离子NH4+ ,检验NH4+ 的操作为:取少量B于试管中,滴加少量NaOH溶液,在试管口附近放一张湿润的红色石蕊试纸,加热,若试纸变蓝,说明B中阳离子为NH4+。
考点:常见阳离子的检验;常见阴离子的检验


科目:高中化学 来源: 题型:填空题
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
对于混合物的分离或提纯,常采用的方法有:过滤、蒸发、蒸馏、萃取、加热分解等。下列各组混和物的分离或提纯应采用什么方法?
(1)实验室中的石灰水久置,液面上常悬浮有CaCO3微粒。可用 的方法除去Ca(OH)2溶液中悬浮的CaCO3微粒。
(2)用CCl4提取溴水中的溴,可采用 的方法。
(3)粗盐中含有不溶性的泥沙、可溶性的氯化钙、氯化镁及一些硫酸盐。对粗盐中的这些杂质可采用 和 的方法除去。
(4)除去氧化钙中的碳酸钙可用 的方法。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
六个未贴标签的试剂瓶中分别装有以下稀溶液①FeSO4、②H2SO4、③BaCl2、④H2O2、⑤Al(NO3)3、⑥NaOH。
(1)某同学想不用其它试剂,仅通过用试管取少量上述溶液进行两两混合实验而给试剂瓶贴上正确的标签,她能成功吗? (填“能”或“不能”)。
(2)实验中发现,有一组在混合时,随着试剂滴加的顺序不同而出现明显不同的现象,该组是 ,有一组在混合时.随着试剂滴加后的时间不同而出现明显不同的现象,该组是为 ,该组涉及氧化还原应的化学方程式 。
(3)鉴别后,该同学又用FeSO4做了三个体现Fe2+还原性的实验,每次加入上述两种已鉴别的物质的溶液与其混合。试写出其中两个反应的离子方程式
(4)以下各种溶液不用任何外加试剂,就能实现鉴别的是
①Al(NO3)3 FeCl3 NaOH FeSO4 NaHCO3
②Na2CO3 BaCl2 AgNO3 Na2SO4 NH3·H2O
③KOH NaCl NaHCO3 MgSO4 KNO3
④CuSO4 KHSO4 NaHCO3 KOH
⑤NaAlO2 Na2SiO3 Na2CO3 NaHSO4 NaCl
⑥NH4Cl Na2SO4 (NH4)2SO4 Ba(OH)2 AlCl3
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2等)中回收V2O5的一种生产工艺流程示意图如下,请回答下列问题:
(1)步骤①中废渣的主要成分是 ,③中X试剂为 。
(2)实验室中进行萃取分液操作时,注入萃取剂,充分振荡,将分液漏斗于铁圈上静置,当液体分层后,接下来的操作是 。
(3)②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂)。
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)为提高②中萃取百分率,应采取的措施是 。
2RAn(有机层) + nH2SO4 (水层)为提高②中萃取百分率,应采取的措施是 。
(4)请完成④中的反应离子方程式:
□ClO3- + □VO2+ +□H+ =□VO3+ + □ +□
(5)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程: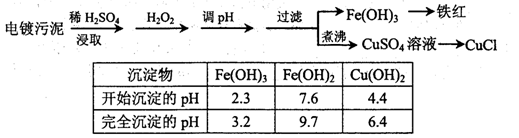
(1)酸浸后加入H2O2的目的是 。调pH步骤中加入的试剂最好是 (填化学式)。实验室进行过滤操作所用到的玻璃仪器有 。
(2)煮沸CuSO4溶液的原因是 。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式 。
(3)CuCl产品中CuCl的质量分数大于96.50%为国家合格标准。称取所制备的CuCl样品0.2500g置于一定量的0.5mol·L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液24.60mL。有关的化学反应为:
Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。通过计算说明该CuCl样品 (填“符合”或“不符合”)国家标准。
(4)25℃时,KSP [Fe(OH)3]= 4.0×10-38。Fe3+发生水解反应Fe3++3H2O Fe(OH)3+3H+,该反应的平衡常数为 。
Fe(OH)3+3H+,该反应的平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
某校化学小组的同学将一批废弃的线路板简单处理后,得到Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计了如下制备强酸铜和硫酸铝晶体的方案: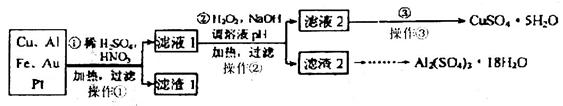
回答下列问题:
(1)第②步加入H2O2是为了除云Fe2+,该反应的离子方程式为_________;
(2)滤渣2的主要成分是Fe(OH)3和Al(OH)3。由滤渣2制取Al2(SO4)3·18H2O实验过程的最后步骤是__________________。
(3)用第③步所得CuSO4·5H2O可制得Cu(OH)2。化学活动小组为探究Cu(OH)2受热分解产物及产物性质,设计如下实验过程:取0.98g Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图所示,产物A、B的化学式分别为____和Cu2O。通过以上实验和图像可以得出如下结论:高温时B______(填“较稳定”或“不稳定”)。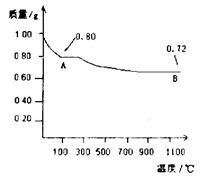
活动小组同学还进行了如下实验:
①甲同学用下列装置进行实验(夹持装置末画出),最终得出的结论是加热时A可将NH3氧化为N2,A被还原为单质Cu,支持甲同学结论的现象是______;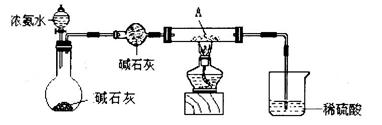
②乙同学用下列实验装置进行实验,实验中观察到混合粉末最终变成红色物质,同时生成一种无色、有刺激性气味的气体,该气体化学式为_______;有人认为乙同学的实验装置中在装B物质的试管与烧杯之间需加一个防倒吸装置,你认为是否有必要_____,若有必要请简述原因并加以改进____________。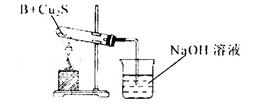
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(8分)(1) 某实验室要用90mL1.00 mol·L-1的NaOH溶液。在配制该NaOH溶液的过程中:
①除了要使用托盘天平、药匙、烧杯、玻璃棒、胶头滴管,还要使用的仪器有 。
②需用托盘天平称取NaOH的质量为 g。
(2)从海带中提取碘的流程如下图:
①指出提取碘的过程中实验操作、操作的名称:a__________、c__________
②在3mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是
。(注:下图试管中深色区为紫红色溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数。
(1)按照甲同学的观点,发生反应的离子方程式为 。
(2)乙同学认为有Cu(OH)2生成的理论依据是 (用离子方程式表示)。
(3)两同学利用下图所示装置进行测定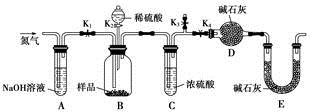
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为 、洗涤、干燥。
②装置E中碱石灰的作用是 。
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是 (填选项序号,下同)。
若未进行步骤 ,将使测量结果偏低。
④若沉淀样品的质量为m g,装置D的质量增加了n g,则沉淀中CuCO3的质量分数为 。
(4)丙同学认为还可以通过测量CO2的体积或测量 来测定沉淀中CuCO3的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com