
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下:
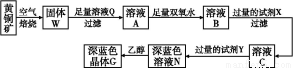
已知25 ℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
| Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀pH | ≥9.6 | ≥6.4 | ≥3.2 |
(1)加快黄铜矿焙烧速率,可采用的措施有 (写两种)。
(2)加入双氧水可能发生反应的离子方程式为 ;
试剂X的化学式为 。
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为 ,用pH试纸测该溶液pH的方法是 。
(4)已知Cu(OH)2+4NH3·H2O [Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。
[Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。
(5)在溶液N中加入乙醇的目的是 。
(1)将黄铜矿粉碎、升高温度、增大空气流速(任选两种)
(2)2Fe2++2H++H2O2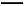 2Fe3++2H2O CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3中的任一种
2Fe3++2H2O CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3中的任一种
(3)1×10-5 取一小片pH试纸放在玻璃片或表面皿上,用玻璃棒或胶头滴管取待测液点在pH试纸中部,待颜色变化稳定后与标准比色卡对比,读出pH
(4)K=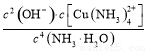
(5)降低G的溶解度,促进深蓝色晶体析出
【解析】(1)对于固体反应物燃烧来讲,加快化学反应速率的措施有:①增大固体接触面积;②升高温度;③增大空气流速(即增大O2浓度);④利用超声波等;结合本题的情况,①②③都符合。
(2)从该题的工艺流程,再结合产物的阴离子,溶液Q应为H2SO4溶液,则溶液A中有:Fe2+、Fe3+、Cu2+和过量H2SO4,再结合所给数据,知此工艺应将Fe2+ Fe3+,然后让Fe3+水解成Fe(OH)3沉淀滤去,而Cu2+则不能形成沉淀,而要保证Fe3+水解形成沉淀[由于Fe3++3H2O
Fe3+,然后让Fe3+水解成Fe(OH)3沉淀滤去,而Cu2+则不能形成沉淀,而要保证Fe3+水解形成沉淀[由于Fe3++3H2O Fe(OH)3+3H+],则需要减小溶液酸性,所以双氧水的作用是将Fe2+氧化成为Fe3+,过量的试剂X的作用是能够促进Fe3+
Fe(OH)3+3H+],则需要减小溶液酸性,所以双氧水的作用是将Fe2+氧化成为Fe3+,过量的试剂X的作用是能够促进Fe3+ Fe(OH)3,即要促进Fe3+水解向右进行,那么则需要消耗H+又不能引入新的杂质,结合题中物质应该加入含铜元素又能消耗H+且不引入杂质的物质,则X为CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3。
Fe(OH)3,即要促进Fe3+水解向右进行,那么则需要消耗H+又不能引入新的杂质,结合题中物质应该加入含铜元素又能消耗H+且不引入杂质的物质,则X为CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3。
(3)由上面知溶液C主要为CuSO4溶液,则加入Y后能生成[Cu(NH3)4]SO4,则Y为氨水,NH3·H2O N
N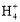 +OH-,K=
+OH-,K=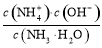 =
=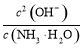 =
=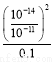 =
=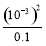 =
=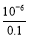 =10-5。
=10-5。
(4)书写时,氢氧化铜固体和水不计入表达式。
(5)深蓝色晶体的主要成分是[Cu(NH3)4]SO4·H2O,加入乙醇的目的是降低其溶解度,促进晶体析出。


科目:高中化学 来源:2014高考化学名师知识点精编 专题1物质的分类分散系练习卷(解析版) 题型:选择题
下列事实与胶体性质无关的是( )
A.一支钢笔使用两种不同型号的蓝黑墨水,易出现堵塞
B.在河流入海口处易形成三角洲
C.清晨,人们经常能看到阳光穿过茂密的树木枝叶所产生的美丽景象
D.Na2SO4溶液中滴加BaCl2溶液产生白色沉淀
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题16硫及其化合物练习卷(解析版) 题型:选择题
下列有关实验现象和解释或结论都正确的选项是( )
选项实验操作现象解释或结论
A把SO2通入紫色石蕊试液中紫色褪去SO2具有漂白性
B把浓硫酸滴到pH试纸上试纸变红浓硫酸具有酸性
C将充满NO2的密闭玻璃球浸泡在热水中红棕色变浅反应2NO2
N2O4的ΔH<0
D向AgCl沉淀中滴加KI溶液白色沉淀
变为黄色溶度积:AgI比
AgCl更小
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题15富集在海水的元素-氯溴碘练习卷(解析版) 题型:选择题
在氯水中存在多种分子和离子,可通过实验的方法加以确定,下列说法中可能错误的是( )
A.加入含有NaOH的酚酞试液,红色褪去,说明有H+存在
B.加入有色布条后,有色布条褪色,说明有HClO分子存在
C.氯水呈浅黄色,且有刺激性气味,说明有Cl2分子存在
D.加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题14无机非金属材料-碳和硅练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.Na2O2与水的反应中,氧化剂是Na2O2,还原剂是水
B.向硅酸钠溶液中滴加盐酸,有白色凝胶生成
C.向AlCl3溶液中逐滴滴加氨水至过量,先出现白色沉淀后溶解
D.工业上可以电解氯化镁溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题13铁、铜及其重要化合物练习卷(解析版) 题型:选择题
某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物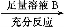 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是( )
A.溶液A和B均可以是盐酸或NaOH溶液
B.溶液A和B均可以选用稀硝酸
C.若溶液B选用浓硝酸,则测得铜的质量分数偏小
D.实验室方案Ⅱ更便于实施
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题12钠、铝及其重要化合物练习卷(解析版) 题型:选择题
下列物质转化在给定条件下能实现的是( )
①Al2O3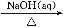 NaAlO2(aq)
NaAlO2(aq)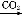 Al(OH)3
Al(OH)3
②S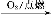 SO3
SO3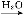 H2SO4
H2SO4
③饱和NaCl(aq)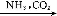 NaHCO3
NaHCO3 Na2CO3
Na2CO3
④Fe2O3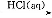 FeCl3(aq)
FeCl3(aq) 无水FeCl3
无水FeCl3
⑤MgCl2(aq) Mg(OH)2
Mg(OH)2 MgO
MgO
A.①③⑤B.①④⑤C.②③④D.②④⑤
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题11电化学练习卷(解析版) 题型:选择题
1 L K2SO4和CuSO4的混合溶液中c(S )=2.0 mol·L-1,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L(标准状况)气体,则原溶液中c(K+)为( )
)=2.0 mol·L-1,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L(标准状况)气体,则原溶液中c(K+)为( )
A.2.0 mol·L-1 B.1.5 mol·L-1
C.1.0 mol·L-1 D.0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷B(解析版) 题型:填空题
常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。
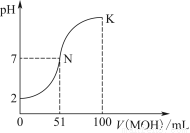
回答下列问题:
(1)由图中信息可知HA为________酸(填“强”或“弱”),理由是________________________________________________。
(2)常温下一定浓度的MA稀溶液的pH=a,则a________________________________________________________7
(填“>”“<”或“=”),用离子方程式表示其原因为_____________________________________________________
此时,溶液中由水电离出的c(OH-)=________。
(3)请写出K点所对应的溶液中离子浓度的大小关系:_________________________________________。
(4)K点对应的溶液中,c(M+)+c(MOH)________2c(A-)(填“>”“<”或“=”);若此时溶液中,pH=10,则c(M+)-c(OH-)=________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com