
【题目】下列离子方程式书写正确的是( )
A.乙酸钠溶液和盐酸混合:CH3COO-+H3O+![]() CH3COOH+H2O
CH3COOH+H2O
B.醋酸钠的水解反应:CH3COO-+ H3O+![]() CH3COOH+H2O
CH3COOH+H2O
C.用石墨电极电解饱和MgCl2溶液:2Cl+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D.向苯酚钠溶液中通入少量CO2:![]()
科目:高中化学 来源: 题型:
【题目】钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,总反应为2Na+xS![]() Na2Sx,其反应原理如图所示。下列叙述正确的是( )
Na2Sx,其反应原理如图所示。下列叙述正确的是( )
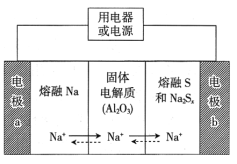
A.放电时,电极a为正极
B.放电时,内电路中Na+的移动方向为从b到a
C.充电时,电极b的反应式为Sx2--2e-=xS
D.充电时,Na+在电极b上获得电子,发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数约为6.02×![]()
![]() ,下列叙述不正确的是( )
,下列叙述不正确的是( )
A.将1 mol ![]() 转化为
转化为![]() 胶体,
胶体,![]() 胶粒数小于6.02×
胶粒数小于6.02×![]()
B.标准状况下,22.4 L![]() 中含有溴原子数约为2×6.02×
中含有溴原子数约为2×6.02×![]()
C.常温下,9.2 g ![]() 含有的分子数小于0.2×6.02×
含有的分子数小于0.2×6.02×![]()
D.25℃时,pH=12的![]() 溶液1 L所含
溶液1 L所含![]() 数约为6.02×
数约为6.02×![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至4min时,若HCl浓度为0.12mol·L-1,则H2反应速率为0.03mol·L-1·min-1
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表中短周期的一部分,下列说法正确的是
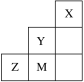
A.电负性:Y>Z>M
B.离子半径:M->Z2->Y-
C.Z和M的最高价含氧酸中非羟基氧原子数分别为2和3
D.Z元素基态原子的轨道表示式为:![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过反应“P4(s)+3NaOH(aq)+3H2O(l)=3NaH2PO2(aq)+PH3(g) ΔH>0”,能制得用于化学镀镍的NaH2PO2。P4的结构如图所示,则下列说法正确的是
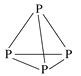
A.白磷中各P原子通过共价键相连接形成共价晶体
B.H2O分子的立体构型为V形
C.该反应能自发进行,则ΔS<0
D.反应产物PH3中磷原子的杂化方式为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温炼铜的反应之一为2CuFeS2+O2![]() Cu2S+2FeS+SO2。
Cu2S+2FeS+SO2。
(1)Cu+基态核外电子排布式为___________。
(2)Cu、Zn的第二电离能:I2(Cu)________(填“>”“<”或“=”)I2(Zn)。
(3)SO2分子中S原子的轨道杂化类型为________,分子的立体构型为________。
(4)[Cu(CH3CN)4]+是非常稳定的络合离子,配体中σ键和π键个数之比为________。
(5)Fe2+、Fe3+能与CN-络合,其结构如图所示。该离子可形成铁蓝钾盐,该钾盐的化学式为_________。
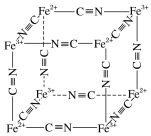
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国制造彰显中国力量,在电影《厉害了,我的国》中重点介绍了中国制造的重点工程,下列所涉及的材料不属于无机非金属材料的是( )
世界最大射电望远镜“中国天眼” |
“嫦娥四号”月球探测器 |
中国大飞机C919 |
中国第一艘深海载人潜水器“蛟龙号” |
A.光导纤维传输线 | B.晶体硅芯片 | C.新型铝锂合金机翼 | D.氮化硅陶瓷发动机 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅是人类较早发现和使用的一种重金属,工业上用铅精矿(主要成分含PbS)为原料,分火法和湿法两种方法冶炼。
Ⅰ.火法冶炼粗铅的流程如下:

(1)焙烧炉中主要反应的化学方程式为______________________。
(2)鼓风炉中焦炭的作用是___________,吸收塔中反应的离子方程式为___________。
Ⅱ.湿法炼铅的工艺流程如下:

已知:①不同温度下PbCl2的溶解度如下表所示。

②PbCl2为能溶于水的弱电解质,在含Cl-的溶液中存在平衡:
PbCl2(aq)+2Cl-(aq)![]() PbCl42-(aq)。
PbCl42-(aq)。
(3)浸取过程中发生反应的离子方程式为______________________。
(4)操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,其合理的解释为___________。
(5)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。则阴极室中的电极反应式为___________;若该电解装置的外接电源为铅蓄电池,每生成20.7g铅,铅蓄电池中消耗硫酸的物质的量为___________。

(6)目前炼铅工艺以火法为主,但湿法炼铅也有其明显的优点,其优点是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com