
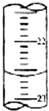
 某研究性学习小组用PH=1的盐酸滴定25.00mL未知物质的量浓度的NaOH溶液,从而求出该NaOH溶液的PH值(选用酚酞作为指示剂)
某研究性学习小组用PH=1的盐酸滴定25.00mL未知物质的量浓度的NaOH溶液,从而求出该NaOH溶液的PH值(选用酚酞作为指示剂)| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
分析 ①本滴定实验还需要装标准液盐酸的酸式滴定管、装待测液的锥形瓶;
②从图中读出数据为22.60mL;
③当滴加最后一滴盐酸,溶液的颜色由黄色变为橙色,且在半分钟内不变色,说明达到终点;算出标准液体积的平均值,根据关系式HCl~NaOH来计算该NaOH溶液的物质的量浓度;
④用公式c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析误差,主要是对标准液所用体积的影响进行分析.
解答 解:①本滴定实验还需要装标准液盐酸的酸式滴定管、装待测液的锥形瓶,
故答案为:酸式滴定管;锥形瓶;
②从图中读出数据为22.60mL,
故答案为:22.60;
③当滴加最后一滴盐酸,溶液的颜色由黄色变为橙色,且在半分钟内不变色,说明达到终点;PH=1的盐酸的浓度为0.1mol/L,标准液体积的平均值为:(19.90mL+20.10mL)=20.00mL,
n(盐酸)=c(盐酸)×V(盐酸)=0.1mol/L×0.0200L=0.0020mol,根据关系式HCl~NaOH可知氢氧化钠的物质的量为0.0020mol,待测液的体积为25.00mL,
NaOH溶液的物质的量浓度:c(NaOH)=$\frac{n(NaOH)}{V(待测液)}$=$\frac{0.0020mol}{0.0250L}$=0.0800mol/L,
故答案为:当滴加最后一滴盐酸,溶液的颜色由黄色变为橙色,且在半分钟内不变色;0.0800;
④用公式c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析误差,主要是对标准液所用体积的影响进行分析,
A.滴定终点读数时俯视读数,读数偏小,所以标准液的体积偏小,结果偏低,故A错误;
B.酸式滴定管使用前,水洗后未用盐酸溶液润洗,标准液被稀释,达到终点时消耗的标准液体积增大,使测定结果偏高,故B正确;
C.锥形瓶水洗后未干燥,水珠附着在瓶壁,对待测液的物质的量没有影响,消耗标准液无影响,所以对结果无影响,故C错误;
D.酸式滴定管尖嘴部分有气泡,滴定后消失,达到终点时消耗的标准液体积增大,使测定结果偏高,故D正确;
故答案为:BD.
点评 本题考查酸碱中和滴定实验,题目难度不大,注意把握实验的原理、步骤、方法以及注意事项,在计算时抓住实验原理即可完成,用公式c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析误差,主要是对标准液所用体积的影响进行分析.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
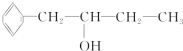
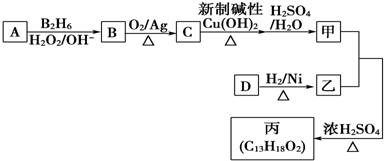
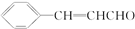 ;
;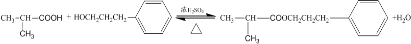 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的氢化物的沸点高于同族其他元素氢化物的沸点 | |
| B. | 阴离子还原性:X>W;阳离子氧化性:Z>Y | |
| C. | X与Y两种元素可形成含有共价键的离子化合物 | |
| D. | Z与W两种元素形成的化合物在水溶液中不能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 反应过程 | 化学方程式 | 不同温度下的K | ||
| 273.15K | 1000K | |||
| Ⅰ | 二甲醚羰基化反应 | CH3OCH3(g)+CO(g)?CH3COOCH3(g) | 1016.25 | 101.58 |
| Ⅱ | 乙酸甲酯加氢反应 | CH3COOCH3(g)+2H2(g)?CH3OH(g)+C2H5OH(g) | 103.97 | 10-0.35 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
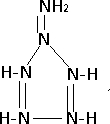 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
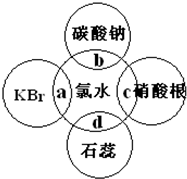 氯水中含有多种成分,因而具有很多性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量).
氯水中含有多种成分,因而具有很多性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅可用于制造光导纤维 | |
| B. | 石英玻璃可用于制造光学仪器 | |
| C. | 玻璃在加热融化时有固定的熔点 | |
| D. | 制普通玻璃的原料是纯碱、石灰石、石英 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com