
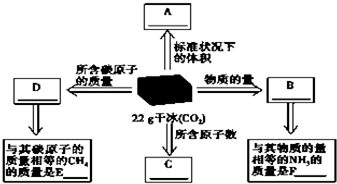
 (1)干冰是固态CO2的俗称,常用做人工降雨,22g干冰与A、B、C、D有如图所示的转化关系,请完成图中方框.
(1)干冰是固态CO2的俗称,常用做人工降雨,22g干冰与A、B、C、D有如图所示的转化关系,请完成图中方框.| m |
| M |
| V |
| Vm |
| n |
| V |
| m |
| n |
| 22g |
| 44g/mol |
| 22.4L |
| 22.4L/mol |
| 1mol |
| 0.2L |
| 0.5mol/L×0.3L |
| 1.5mol/L |
| 11.7g |
| 0.2mol |


科目:高中化学 来源: 题型:
A、乳酸薄荷醇酯(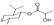 )仅能发生水解、氧化、消去反应 )仅能发生水解、氧化、消去反应 |
B、乙醛和丙烯醛(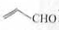 )不是同系物,它们与氢气充分反应后的产物也不是同系物 )不是同系物,它们与氢气充分反应后的产物也不是同系物 |
| C、淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖 |
| D、CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH3CH3+Cl2
| ||
| B、由油脂得到甘油,由淀粉得到葡萄糖;均发生了水解反应 | ||
| C、Cl2+2Br-═2Cl-+Br2,Zn+Cu2+═Zn2++Cu,均为单质被还原的置换反应 | ||
| D、2Na2O2+2H2O═4NaOH+O2↑,Cl2+H2O═HCl+HClO,均为水作还原剂的氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、集气瓶中气体的黄绿色逐渐变浅 |
| B、集气瓶内壁上有油状液滴附着 |
| C、集气瓶底部出现黑色颗粒 |
| D、取下玻璃片,可能会看到白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、复合材料保持了原材料的优点,又有优于原材料的特点 |
| B、玻璃钢是一种新型合金材料,其强度和韧性都强于钢铁 |
| C、“神六”飞船使用了大量的复合材料 |
| D、铜是一种有色金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
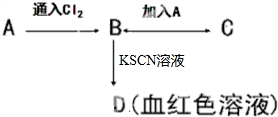 A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,B溶液呈现黄色,C的溶液呈现浅绿色,A、B、C、D之间有如图所示转化关系.
A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,B溶液呈现黄色,C的溶液呈现浅绿色,A、B、C、D之间有如图所示转化关系.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com