


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
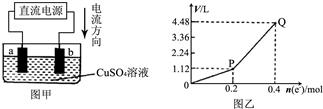 用惰性电极电解一定量的硫酸铜溶液,实验装置如图甲.电解过程中的实验数据如图乙,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).则下列说法不正确的是( )
用惰性电极电解一定量的硫酸铜溶液,实验装置如图甲.电解过程中的实验数据如图乙,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).则下列说法不正确的是( )| A、电解过程中,a电极表面先有红色物质析出,后有气泡产生 |
| B、b电极上发生的反应方程式为:4OH--4e-=2H2O+O2↑ |
| C、曲线0~P段表示O2的体积变化 |
| D、从开始到Q点时收集到的混合气体的平均摩尔质量为12g?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、H2O2的电子式: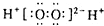 |
| B、结构简式(CH3)2CHOH可以表示1-丙醇,也可以表示2-丙醇 |
| C、二氧化硅的分子式:SiO2 |
| D、质子数为8,中子数为10的氧原子:818O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②⑤ | B、②④⑤⑦ |
| C、②⑤⑥⑦ | D、全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 开始沉淀 | 完全沉淀 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| Cr(OH)3 | 4.6 | 5.6 |
| Zn(OH)2 | 6.0 | 8.0 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
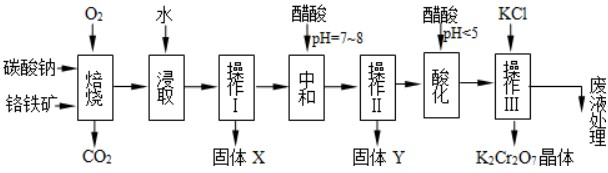
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com