
【题目】实验室制备硫酸亚铁晶体步骤如下:取洁净铁屑于烧杯中,加入一定量的稀硫酸,在50℃水浴中加热一段时间,趁热过滤,滤液转移至锥形瓶中,置于冰水浴中冷却,经一系列操作后获得产品。下列说法不正确的是( )
A.反应过程中烧杯底部一般保留少量铁屑以提高产品纯度
B.硫酸溶液浓度过低会降低晶体产率
C.水浴加热可以加快反应速率同时避免生成的![]() 发生爆炸
发生爆炸
D.与室温冷却相比,冰水浴冷却滤液可以更快获得更多更大的晶体
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】溴与氢气在一定条件下反应的热化学方程式如下:
①Br2(g)+H2(g)2HBr(g) △H=-Q1kJ·mol-1
②Br2(l)+H2(g)2HBr(g) △H =-Q2kJ·mol-1
下列说法正确的是
A.Q1<Q2
B.1molHBr(g)具有的能量大于1molHBr(l)具有的能量
C.相同条件下,Cl2(g)+H2(g)2HCl(g) △H >-Q1kJ·mol-1
D.向1molBr2(g)中加入1molH2(g)在该条件下充分反应,放出Q1kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“清肺排毒汤”来源于中医经典方剂组合,对新冠肺炎病毒感染的轻型、普通型的治疗具有良好的效果。其中的一味中药黄芩,其有效成分黄芩苷的结构简式如下图所示,下列有关黄芩苷的说法中正确的是( )
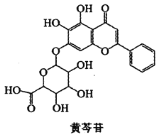
A.属于芳香族化合物,分子式为![]()
B.分子中苯环上的一氯代物有4种
C.可发生取代反应、加成反应,不能发生氧化反应
D.与足量![]() 发生加成反应后,官能团种类减少1种
发生加成反应后,官能团种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述正确的是
A.电解CuCl2溶液:CuCl2=Cu2++2Cl-
B.Mg和Cl形成离子键的过程:![]()
C.向Al2(SO4)3溶液中滴加Na2CO3溶液:2Al3++3CO32-=Al2(CO3)3↓
D.乙酸与乙醇发生酯化反应:CH3COOH+C2H518OH![]() CH3CO18OC2H5+H2O
CH3CO18OC2H5+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关用水杨酸和乙酸酐制备阿司匹林(乙酰水杨酸)的说法中不正确的是( )
A.制备阿司匹林的反应属于取代反应
B.待反应结束后向锥形瓶中加水,冰水浴中冷却结晶,减压过滤,用少量冷水淋洗锥形瓶收集所有晶体
C.粗产品中常混有聚合物杂质,可利用![]() 溶液溶解、过滤、洗涤、盐酸酸化、结晶等操作进行精制
溶液溶解、过滤、洗涤、盐酸酸化、结晶等操作进行精制
D.可用![]() 溶液检验阿司匹林中是否含有未反应完的水杨酸
溶液检验阿司匹林中是否含有未反应完的水杨酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别在三个容积均为2.0L的恒容密闭容器中发生反应:A(g)+B(g)D(g)。其中容器甲中反应进行至5min时达到平衡状态,相关实验数据如表所示:
容器 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | 化学平衡常数 | ||
n(A) | n(B) | n(D) | n(D) | |||
甲 | 500 | 4.0 | 4.0 | 0 | 3.2 | K1 |
乙 | 500 | 4.0 | a | 0 | 2.0 | K2 |
丙 | 600 | 2.0 | 2.0 | 2.0 | 2.8 | K3 |
下列说法不正确的是
A.0~5min内,甲容器中A的平均反应速率v(A)=0.64mol·L-1·min-1
B.a=2.2
C.若容器甲中起始投料为2.0molA、2.0molB,反应达到平衡时,A的转化率小于80%
D.K1=K2>K3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面四个反应中,反应类型与其它三个不同的是
A.CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
B.CH3CH2Br+NaOH![]() CH3CH2OH+NaBr
CH3CH2OH+NaBr
C.C6H5OH+3Br2 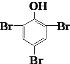 +3HBr
+3HBr
D.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氯化氢为原料通过直接氧化法可以制取氯气,反应方程式为:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) 。
(1)该法可按下列催化过程进行:
CuCl2(s)CuCl(s)+![]() Cl2(g) ΔH1=83 kJ·mol-1
Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+![]() O2(g)CuO(s)+
O2(g)CuO(s)+![]() Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
①总反应4HCl(g)+O2(g)2Cl2(g)+2H2O(g)的ΔH=____kJ·mol-1。
②有利于提高总反应平衡产率的条件有______。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)恒温恒压下,可以说明总反应4HCl(g)+O2(g)2Cl2(g)+2H2O(g)达到平衡的是_________。
A.压强不变
B.氯气的体积分数保持不变
C.每生成2个H—O的同时,有4个H—Cl生成
D.反应速率v正(O2)∶v逆(H2O)=1∶2
E.各组分的物质的量浓度都相等

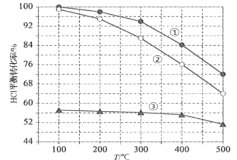
(3)密闭容器中充入HCl和O2进行反应,c(HCl)随时间t的变化曲线如图1,保持其他条件不变,t2时升温,t3时重新达平衡,画出t2—t4时c(Cl2)随时间t的变化曲线____。
(4)在刚性容器中,进料浓度比c(HCl) ∶c(O2)分别等于1∶1、4∶1、7∶1时,HCl平衡转化率随温度变化的关系如图2:
①其中曲线①代表的c(HCl) ∶c(O2)是__________,原因__________。
②设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=4∶1的数据计算K(400℃)=__________(列出计算式,不必算出结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)第四周期中,未成对电子数最多的元素是________,(填名称)它位于第________族;核外电子排布式是__________________。它有________种运动状态不同的电子,其价电子排布图为:______________。
(2)已知NH5为离子化合物,写出其电子式:________。
(3)某同学根据掌握的知识分析Mg的核外电子排布为![]() 。该同学所画的电子排布图违背了________。
。该同学所画的电子排布图违背了________。
(4)在基态 14C原子中,核外存在________对自旋相反的电子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com