
| A. | x值为1 | B. | 混合气体的密度增大 | ||
| C. | 平衡时N的浓度为 0.6 mol/L | D. | N的转化率为80% |
分析 A.根据n=cV计算生成Q的物质的量,结合R的物质的量,利用物质的量之比等于化学计量数之比计算x的值;
B.容器的容积不变,混合气体的质量不变,根据ρ=$\frac{m}{V}$判断;
C.根据生成的R的物质的量,利用物质的量之比等于化学计量数之比计算参加反应的N的物质的量,N的平衡浓度=$\frac{n}{V}$;
D.根据C可知参加反应的N的物质的量,然后根据转化率的表达式计算出N的转化率.
解答 解:A.平衡时生成的Q的物质的量为:0.4mol/L×2L=0.8mol,生成R为2.4mol,物质的量之比等于化学计量数之比,故0.8mol:2.4mol=x:3,解得x=1,故A正确;
B.反应体系中各组分都是气体,混合气体的质量不变,容器的容积恒定,根据ρ=$\frac{m}{V}$可知混合气体的密度不变,故B错误;
C.反应达到平衡时,生成2.4molR,由方程式2M(g)+3N(g)?x Q(g)+3R(g)可知,参加反应的N的物质的量为2.4mol,故平衡时N的物质的量为3mol-2.4mol=0.6mol,N的平衡浓度为:c(N)=$\frac{0.6mol}{2L}$=0.3mol/L,故C错误;
D.参加反应的N的物质的量为2.4mol,则N的转化率为:$\frac{2.4mol}{3mol}$×100%=80%,故D正确;
故选AD.
点评 本题考查了化学平衡的计算,题目难度中等,注意掌握化学反应速率、物质的量浓度、转化率等概念及计算方法,明确有关化学平衡的计算方法,试题侧重考查学生的分析、理解能力及化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③①④ | C. | ②①③④ | D. | ③②④① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8g | B. | 16g | C. | 24g | D. | 32g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
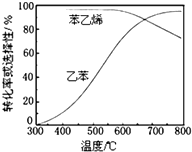 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: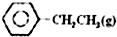 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$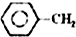 =CH2(g)+H2(g)
=CH2(g)+H2(g)| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2min内,用NO表示的该反应的平均速度v(NO)=0.03mol•L-1•min-1 | |
| B. | 容器内混合气体密度保持不变可以说明反应达到平衡状态 | |
| C. | T℃时,该反应的平衡常数K=$\frac{9}{32}$ | |
| D. | 升高温度,可以提高反应速率和NO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
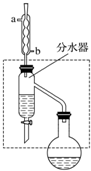 乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$ CH3COOCH2CH2CH2CH3+H2O
乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$ CH3COOCH2CH2CH2CH3+H2O| 乙酸 | 正丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.0 |
| 密度/g•cm-3 | 1.1 | 0.80 | 0.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
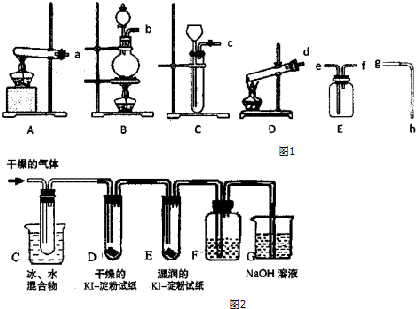
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 | 试剂及操作 | 现象 | |
| 试管 | 滴管 | ||
 1.0mL | 饱和Na2SlO3溶液(含2滴酚酞) | 先滴加1.0mL0.5mol•L-1NaOH溶液:再滴加1.5mL1.0mol•L-1H2SO4溶液 | Ⅰ.红色溶液中出现胶状沉淀 |
| 0.1mol•L-1AlCl3溶液 | Ⅱ.加碱时出现白色沉淀,又逐渐溶解直至消失;加酸时产生白色沉淀,又逐渐溶解直至消失 | ||
| 0.1mol•L-1Fe(NO3)2溶液 | Ⅲ.加碱时生成白色沉淀迅速变成灰绿色,最后变成红褐色;加酸后溶液变为黄色 | ||
| 新制饱和氯水 | Ⅳ.加碱时溶液变为无色;加酸后无色溶液变为浅黄绿色 | ||
| 实验 | 试剂及操作 | 现象 | |
| 试管 | 滴管 | ||
 1.0 mL | 0.1 mol•L-1 Fe(NO3)2溶液 | 先滴加1.5 mL 1.0 mol•L-1 H2SO4溶液; 再滴加1.0 mL 0.5 mol•L-1 NaOH溶液 | V.加酸时溶液无明显现象;加碱后溶液依然没有明显变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com