
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 二氧化硫和氯水有漂白性 | 两者都能使溴水褪色 |
B | 硫酸铜可以用做游泳池消毒剂 | 铜盐能使蛋白质变性 |
C | 盐酸和氨水能溶解氢氧化铝 | 氢氧化铝是两性氢氧化物 |
D | 用淀粉-碘化钾溶液鉴别氯化亚铁 | 亚铁离子有氧化性 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年广西桂林中学高二上期中考试文化学试卷(解析版) 题型:填空题
某有机物的化学式为 C2H4O2,能与碳酸钠反应放出二氧化碳,则该有机物的结构简式是为 ,官能团的名称是_ _。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东广州执信中学高二上期中文化学试卷(解析版) 题型:?????
误食重金属盐而引起的中毒,急救方法是( )
A.服用大量生理盐水 B.服用大量冷开水
C.服用大量的豆浆或牛奶 D.服用大量小苏打溶液
查看答案和解析>>
科目:高中化学 来源:2016届四川成都第七中学高三阶段测试三理综化学试卷(解析版) 题型:填空题
甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,二氧化碳加氢合成甲醇是合理利用二氧化碳的有效途径。由二氧化碳制备甲醇过程中可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H1=-49.58KJ/mol
CH3OH(g)+H2O(g) △H1=-49.58KJ/mol
反应Ⅱ:CO2(g)+H2(g)  CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)  CH3OH(g) △H3=-90.77KJ/mol
CH3OH(g) △H3=-90.77KJ/mol
回答下列问题:
(1)反应Ⅱ的△H2= ,反应Ⅰ自发进行条件是 (填“较低温”、“较高温”或“任意温度”)。
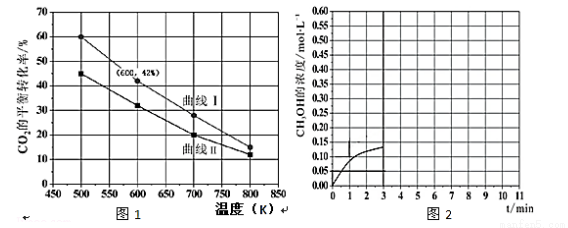
(2)在一定条件下3L恒容密闭容器中,充入一定量的氢气和二氧化碳仅反应反应Ⅰ,实验测得反应物在不同起始投入量下,
体系中二氧化碳的平衡转化率与温度的关系曲线,如图1所示。
① 氢气和二氧化碳的起始的投入量以A和B两种方式投入
A:n(H2)=3mol n(CO2)=1.5mol
B:n(H2)=3mol n(CO2)=2mol,曲线Ⅰ代表哪种投入方式 (用A、B表示)
②在温度为500K的条件下,按照A方式充入3摩尔氢气和1.5摩尔二氧化碳,该反应10分钟时达到平衡:A.此温度下的平衡常数为 ;500K时,若在此容器中开始充入0.3摩尔氢气和0.9摩尔二氧化碳、0.6摩尔甲醇、x摩尔水蒸气,若使反应在开始时正向进行,则x应满足的条件是 。
b.在此条件下,系统中甲醇的浓度随反应时间的变化趋势如图2所示,当反应时间达到3分钟时,迅速将体系温度升至600K,请在图2中画出3~10分钟内容器中甲醇的浓度变化趋势曲线。
(3)固体氧化物燃料电池是一种新型的燃料电池,它是以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,该电池的工作原理如图3所示,其中多孔电极均不参与电极反应。图3是甲醇燃料电池的模型。
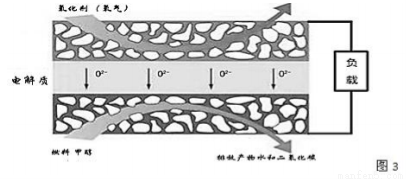
①写出该燃料电池的负极反应式 。
②如果用该电池作为电解装置,当有16g甲醇发生反应时,则理论上提供的电量最多为 摩尔。
查看答案和解析>>
科目:高中化学 来源:2016届山西平遥中学等重点中学高三第三次练兵化学试卷(解析版) 题型:实验题
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用潮湿的氯酸钾和草酸(H2C2O4)在60℃时反应制得。某学生拟用下如所示的装置模拟制取并收集二氧化氯。
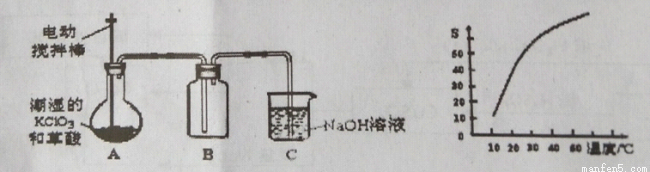
(1)B必须放在冰水浴中控制温度,其原因是 。
(2)反应后在装置C中可的NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2溶解度曲线,请补充从NaClO2溶液中制NaClO2操作步骤:a ;b ;③洗涤;④干燥。
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
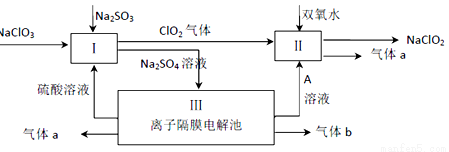
①Ⅱ中反应的离子方程式是 。
②ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该反应化学方程式 。
③NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别于足量硫酸亚铁溶液反应时,消耗亚铁离子物质的量 。(填“相同”,“不同”或“无法判断”)
查看答案和解析>>
科目:高中化学 来源:2016届宁夏回族自治区银川一中高三上第五次月考理化学试卷(解析版) 题型:填空题
300℃下,将2 mol SO2 1 mol O2混合于2 L的恒容密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH,2分钟末达到平衡,测得SO2的转化率为60%。请根据化学反应的有关原理回答下列问题:
2SO3(g) ΔH,2分钟末达到平衡,测得SO2的转化率为60%。请根据化学反应的有关原理回答下列问题:
(1)能证明反应已经达到平 衡状态的是
衡状态的是
①c(SO2):c(O2):c(SO3)=2:1:2
②单位时间内生成nmol SO3的同时消耗nmol SO2
③反应速率2v(SO3)= v(O2)
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
(2)如图表示该反应的速率(v)随时间(t)的变化的关系:
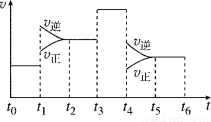
据图分析:你认为t3时改变的外界条件可能是________;t6时保持体积不变向体系中充入少量He气,平衡 移动。(填“向左”“向右”或“不”)。SO2%含量最高的区间是
(t0~t1,t2~t3,t3~t4,t5~t6)。
(3) 300℃时,该反应的平衡常数为 ,若升高温度该反应的平衡常数减小,则ΔH 0(填“大于”小于“或“不确定”)
(4)如果在相同条件下,上述反应从逆反应方向进行,开始时加入SO20.6 mol加入SO31.4 mol,若使平衡时各物质的量浓度与原来平衡相同,则还应加入O2 mol。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏回族自治区银川一中高三上第四次月考理化学试卷(解析版) 题型:实验题
毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2?2H2O的流程如下:
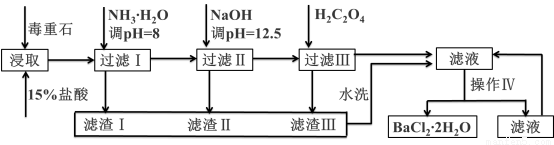
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀的pH | 11.9 | 9.1 | 1.9 |
完全沉淀的pH | 13.9 | 11.1 | 3.2 |
已知:Ksp(BaC2O4)= 1.6×10–7,Ksp(CaC2O4)= 2.3×10–9
(1)实验室用37%的盐酸配制1mol/L盐酸,除烧杯外,还需要使用下列玻璃仪器中的:______________。
a.容量瓶 b.量筒 c.玻璃棒 d.滴定管
为了加快毒重石的酸浸速率,可以采取的措施有:_______________________。(至少两条)
(2)加入氨水调节溶液pH=8的目的是:________________________________。滤渣Ⅱ中含__________(填化学式)。加入H2C2O4时应避免过量,原因是:_____________________________。
(3)操作Ⅳ的步骤是:蒸发浓缩、冷却结晶、____________。
(4)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42—+2H+=Cr2O72—+H2O Ba2++CrO42—=BaCrO4↓
步骤Ⅰ 移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
氯化钡溶液浓度为______________________ mol·L-1(用含字母的式子表示)。若步骤Ⅱ中滴加盐酸时有少量待测液溅出,则Ba2+浓度的测量值将___________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源:2016届福建省三明市高三上学期第二次月考化学试卷(解析版) 题型:选择题
图示为某有机物的结构简式,1mol此有机物与足量NaOH溶液充分反应,消耗NaOH的物质的量为
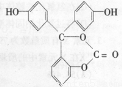
A.6mol B.5mol C. 4mol D.2mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上期中测试化学试卷(解析版) 题型:选择题
向pH相等的一元酸HA和HB溶液中分别加入适量的锌粒,充分反应后,当收集到的H2的体积相等时,消耗酸的体积V(HA)>V(HB),下列分析正确的是
A.消耗锌的质量:HA>HB B.HA一定为强酸
C.生成H2的平均速率:v(HA)< v(HB) D.酸性:HB>HA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com